
A finales de la década de los noventa, un grupo de científicos de la Universidad McGill del Quebec, en Canadá, empezó a investigar cómo influyen las experiencias de niñez en la capacidad de gestionar el estrés durante la edad adulta. Trabajaban con ratas, debido a los grandes parecidos genéticos que tienen con las personas y a que las hembras de esta especie cuidan mucho a sus crías. No solo las alimentan y les dan calor, sino que las limpian, las arrullan y juegan con ellas (Figura 1). Y durante los primeros días de vida, no las dejan nunca solas, solo unos minutos de vez en cuando para alimentarse ellas. Pero rápidamente vuelven a su lado.
El experimento, publicado en 2004, era muy simple (Champagne et al., 2004). Durante la primera semana de vida separaban cada día a las madres de sus crías tres horas seguidas. Les ponían un biberón, para que el hambre no fuera un factor de estrés, y una mantita térmica, para que no pasaran frío. Para las ratas, este periodo equivale a los dos primeros años de vida de un niño. Al hacerse adultas, estas ratas que se han sentido desprotegidas tres horas cada día se vuelven mucho más reactivas e impulsivas ante situaciones de estrés, y son mucho menos curiosas y sociables que las que no han sido nunca separadas de sus madres.
Este hecho, como se ha demostrado, se correlaciona con un incremento significativo en la expresión del gen del receptor de glucocorticoides en una zona muy concreta del cerebro, el hipotálamo. El hipotálamo está implicado en la consolidación de la memoria y en la respuesta hormonal al estrés. Sin embargo, ¿cuál es el motivo por el que la sensación de desprotección durante la niñez propicia cambios en la expresión de este gen? ¿Y qué significado biológico tiene? Como se comprobó una década más tarde, el motivo hay que buscarlo en las modificaciones epigenéticas, que condicionan la función génica sin alterar los genes; y el significado biológico es la adaptación de la función de los genes al entorno concreto donde se desarrolla y vive cada individuo.
Modificaciones epigenéticas: señales para regular el funcionamiento del genoma
El genoma humano, como el de todos los mamíferos, está formado por unos 20.300 genes aproximadamente. Todas las células de un individuo tienen el mismo genoma, es decir, el mismo número y tipo de genes, y también los mismos alelos; es decir, las mismas variantes génicas, las cuales comportan pequeñas diferencias en el mensaje que contienen los genes. Sin embargo, no todos los genes funcionan simultáneamente en todas las células, ni lo hacen con la misma intensidad. Los genes se expresan solo donde y cuando es necesaria su actividad. Hay genes que se tienen que conectar y desconectar de forma dinámica y precisa, para que la célula en cuestión pueda responder de forma rápida a las demandas del entorno. Otros genes, en cambio, tienen que estar permanentemente silenciados o alternativamente activados en algunas células, para que estas puedan realizar correctamente su función. Por ejemplo, los genes implicados en la proliferación celular se tienen que desconectar para siempre en las células diferenciadas, que ya no se reproducirán más.
«Las modificaciones epigenéticas no alteran el mensaje que contienen los genes; únicamente regulan su expresión de forma simple y económica»
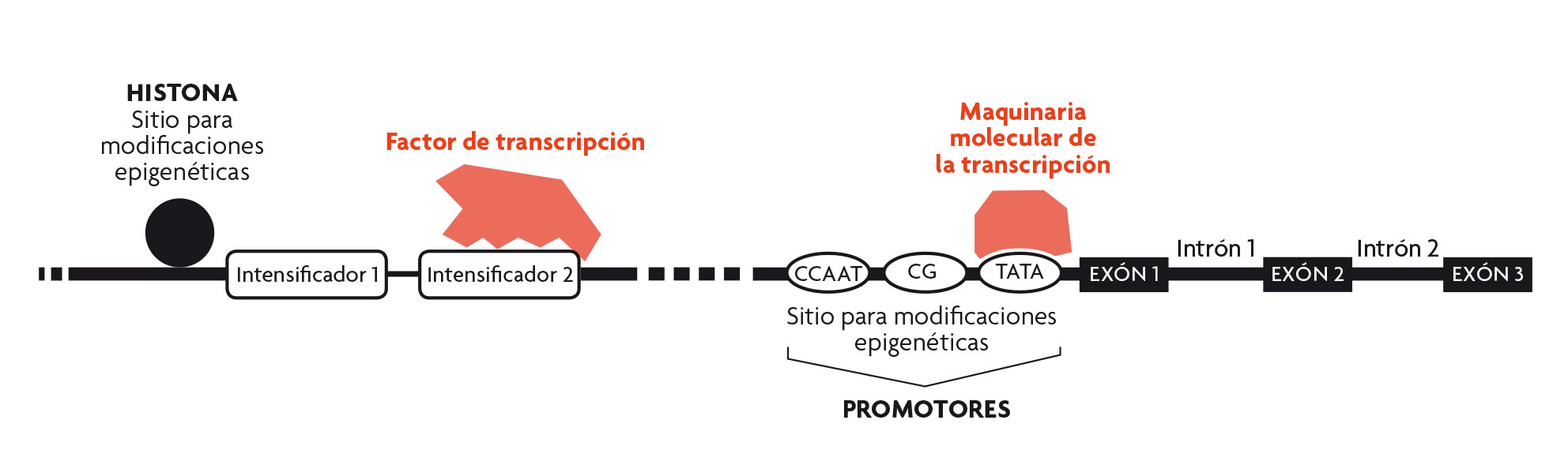
El mecanismo clásico de regulación de la expresión génica (Figura 2), que se conoce desde mediados del siglo xx, se parece a un interruptor. Para que un gen se pueda expresar, hace falta que se unan unas proteínas específicas en unas regiones del ADN que se encuentran normalmente ante la zona codificante del gen. Estas proteínas se denominan de forma genérica factores de transcripción, y las regiones del ADN a las que se unen, intensificadores. Cada gen tiene sus propios intensificadores, que indican dónde y cuándo tiene que funcionar, pero sin los factores de transcripción adecuados, el gen se mantiene inactivo. En este contexto, los factores de transcripción serían como los dedos que pulsan los interruptores, es decir, los intensificadores, para hacer que un gen concreto se exprese. Del mismo modo, también hay factores de transcripción que actúan de silenciadores y evitan así que el gen correspondiente funcione.
Este sistema resulta muy útil cuando hay que regular de forma dinámica y rápida la expresión de los genes, pero resulta energéticamente muy costoso. Las modificaciones epigenéticas permiten abaratarlo. Estas consisten en la adición de moléculas concretas a zonas específicas del genoma, normalmente al inicio de la zona codificante de un gen, o bien en las proteínas histonas que acompañan al ADN para darle estabilidad. Es como poner una señal de tráfico de «prohibido circular» en una calle para evitar que pasen vehículos, o una de «dirección obligatoria» si queremos que todos sigan un mismo sentido. Del mismo modo que una señal de tráfico no altera la forma de la calle o de la carretera donde está puesta, sino que únicamente regula el flujo de vehículos de manera sencilla, las modificaciones epigenéticas tampoco alteran el mensaje que contienen los genes; únicamente regulan su expresión de forma simple y económica, sin necesidad de ir sintetizando factores de transcripción.
Tipos de modificaciones epigenéticas
Existen varios tipos de modificaciones epigenéticas, según dónde se establecen. Las hay que se añaden directamente al ADN, normalmente justo antes del inicio de la zona codificante de los genes, en unas secuencias muy concretas de nucleótidos que se denominan islas CG –dado que están formadas únicamente por nucleótidos citocina (C) y guanina (G)–. Consisten en la adición de grupos metilo, una molécula química cuya fórmula es -CH3, y su función es bloquear completamente la expresión del gen al cual están vinculadas. Así, cuando un gen no se tiene que expresar más en un tipo celular determinado, se metila. En este proceso intervienen varias enzimas, que de forma muy controlada se encargan de metilar los genes oportunos, las metiltransferasas.
El resto de modificaciones epigenéticas se añaden a las histonas, que son las proteínas que acompañan al ADN para darle estabilidad estructural y funcional. En este caso, la situación es mucho más compleja. Las modificaciones epigenéticas más habituales que se establecen sobre las histonas son las acetilaciones. Consisten en la adición de grupos acetil (-CH3O) en aminoácidos concretos de las histonas, los cuales actúan de forma completamente opuesta a las metilaciones del ADN. Su función es mantener siempre activo, es decir, expresándose, el gen al que se encuentran vinculadas. También hay varias enzimas que de forma controlada se encargan de acetilar las histonas adecuadas, las acetilasas. A través de este sistema no hace falta que la célula vaya produciendo factores de transcripción para mantener activos los genes que se encuentran bajo control de las acetilaciones, lo que abarata la regulación, puesto que deja fijados los genes que hay que mantener permanentemente activos.
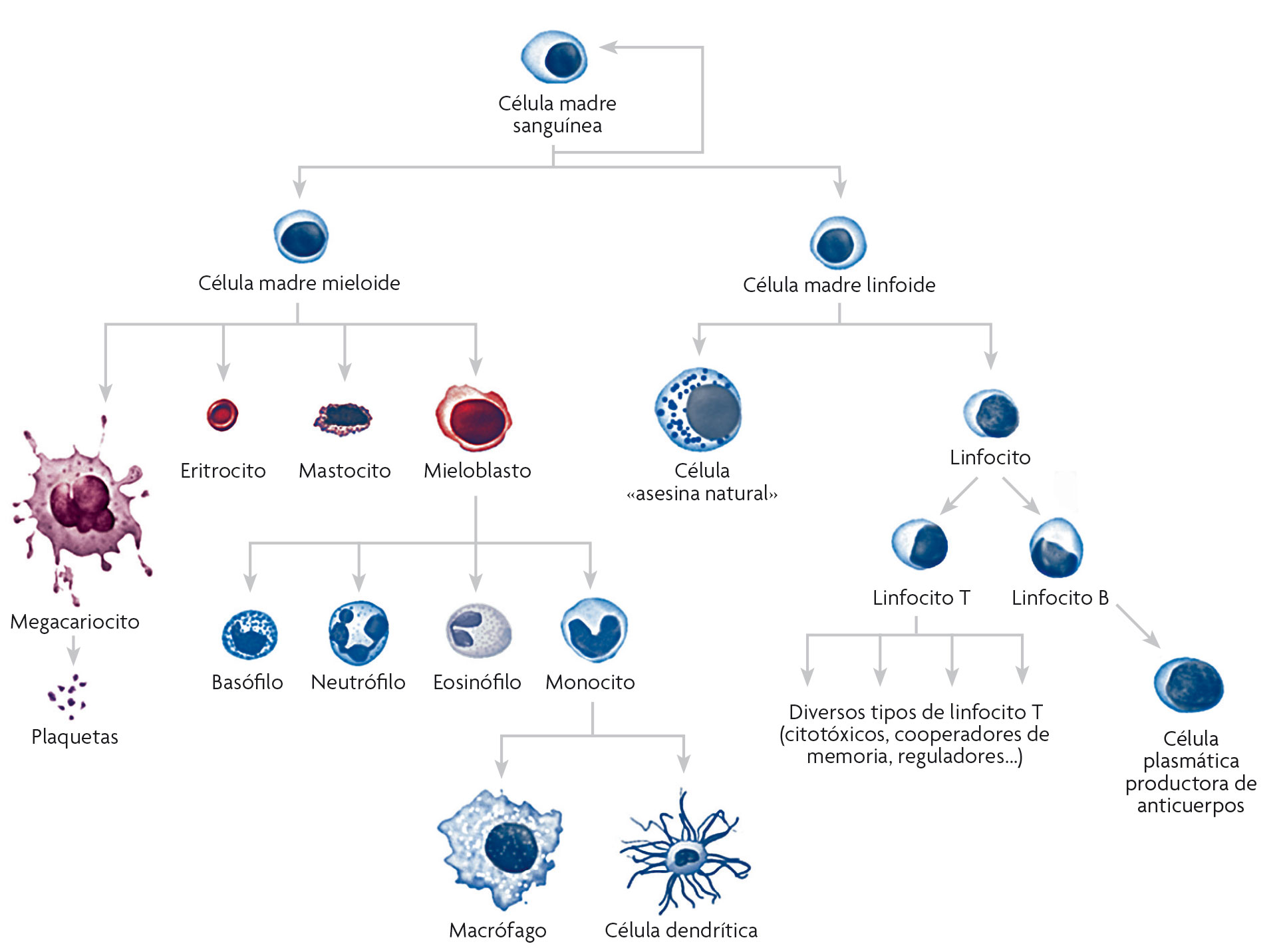
Uno de los sistemas celulares donde se ha analizado con más profundidad la función de las metilaciones y las acetilaciones epigenéticas es en la línea hematopoyética, que genera las diversas células sanguíneas. Es un sistema celular muy complejo, formado por muchos tipos celulares diferentes (linfocitos, eritrocitos, etcétera; véase la Figura 3), los cuales provienen de unas mismas células progenitoras mediante procesos de diferenciación sucesivos. A cada proceso de diferenciación se activan o se desactivan unos genes determinados, y la forma de asegurar que se mantienen activados o silenciados de forma permanente es introduciendo las modificaciones epigenéticas correspondientes de manera controlada.
«Las células disponen de una compleja maquinaria enzimática encargada de añadir y también de eliminar los diversos tipos de modificaciones epigenéticas»
Las modificaciones epigenéticas que se establecen en las histonas son, sin embargo, mucho más complejas. Las más abundantes son las acetilaciones, pero no son las únicas. Se han detectado muchas más, como por ejemplo grupos metilo, fosfato, ubiquitina, sumoilina, biotina y poli-ADP ribosina, cada uno de los cuales tiene su propia fórmula química. En estos casos, la función reguladora depende tanto de la molécula concreta que se añade como también del aminoacil donde se ha unido en las histonas, y actúan en conjunto de forma combinatorial. Esto permite que la activación no sea una cuestión de todo o nada (es decir, o se expresa o está silenciado), sino que introduce grados en la funcionalidad de los genes. En todos los casos existen enzimas específicas que regulan la adición de estas moléculas estrictamente.
¿Qué pasa cuando no se establecen de manera correcta?
Las modificaciones epigenéticas contribuyen a garantizar el funcionamiento correcto de los programas genéticos necesarios para cada tipo celular. Esto implica que los errores epigenéticos, es decir, la carencia o el exceso de metilaciones o acetilaciones, pueden ocasionar patologías, debidas al funcionamiento anómalo de los genes implicados. Uno de los casos más estudiados, por su relevancia sanitaria y social, es el de la generación de tumores. Todos los procesos cancerosos tienen un origen genético, dado que implican genes que se expresan en células en las que no lo tendrían que hacer, como por ejemplo los implicados en la proliferación celular en células diferenciadas, o alternativamente, genes que han quedado silenciados en células en las que se tendrían que mantener activos, como por ejemplo los llamados genes supresores de tumores, cuya función es precisamente evitar la proliferación incontrolada de células diferenciadas.
Es uno de los campos que más frutos está dando en biomedicina. Por un lado, permite una mejor diagnosis, la cual va asociada a la utilización de los tratamientos médicos más adecuados según cuál sea el origen genético o epigenético de cada proceso canceroso. Por otro lado, favorece el diseño de nuevos fármacos, algunos de ellos fármacos epigenéticos, los cuales tienen por objetivo revertir las anomalías del epigenoma que causan la patología. En estos momentos hay varias terapias epigenéticas en uso, que utilizan moléculas como la 5-azacitidina y la 5-aza-20-deoxicitidina para bloquear las metiltransferasas, y varias más en ensayo.
Los procesos cancerosos no son las únicas patologías que se han vinculado a alternaciones en el epigenoma. También se ha visto que afectan a dolencias neurodegenerativas como la de Alzheimer; trastornos cerebrales como esquizofrenia, dolencia bipolar y depresión, y patologías cardíacas y metabólicas, como algunos casos de diabetes de tipo 2, obesidad mórbida, etcétera. Es, por tanto, un campo prioritario de investigación en biomedicina.
¿Cómo saben las células a qué genes tienen que incorporar modificaciones
epigenéticas?
Como se ha mencionado, las células disponen de una compleja maquinaria enzimática encargada de añadir y también de eliminar los diversos tipos de modificaciones epigenéticas. En algunos casos, se establecen de manera absolutamente programada, como por ejemplo durante la diferenciación y la maduración de la línea celular hematopoyética. Lo mismo sucede durante la formación y la maduración de los diferentes tipos celulares que constituyen el cuerpo humano, más de 200.
Aun así, a veces no se producen de forma programada, sino que dependen de la interacción con el ambiente, como en el ejemplo con el que he abierto el artículo, el de las ratitas que se sentían abandonadas por sus madres. En este caso, el estrés que provoca no notar la proximidad física de la madre activa genes relacionados con la gestión de este estrés, como por ejemplo el del receptor de glucocorticoides. Inicialmente lo hace mediante el sistema de factores de transcripción ya mencionado, pero si la situación se mantiene en el tiempo, el hecho de que este gen se mantenga sobreactivado propicia que se active la maquinaria enzimática de las modificaciones epigenéticas. Entonces, se añadirán las moléculas correspondientes para mantener este gen, o el que corresponda, sobreactivado –o, en otros casos, para mantenerlo silenciado–. Se han identificado las moléculas implicadas en estos procesos. Es un mecanismo adaptativo que permite asegurar un funcionamiento óptimo del genoma según la situación concreta de cada individuo, al mismo tiempo que permite un ahorro de energía.
En el caso de las ratitas, si no hay una protección materna suficientemente eficaz, les resulta mucho más adaptativo mantener el sistema de estrés sobreactivado, dado que es el mecanismo que permite responder rápidamente ante cualquier amenaza que se pueda producir. Dicho de otro modo, favorece su supervivencia en el entorno concreto donde viven. Ahora bien, a diferencia del mecanismo de regulación de la expresión génica basado en factores de transcripción y en intensificadores, que es muy dinámico, las modificaciones epigenéticas son muy estables, y tienden a mantenerse. Eso hace que estas ratitas, cuando se hacen adultas, sean mucho más reactivas e impulsivas ante situaciones de estrés, y mucho menos curiosas y sociables. De hecho, estos rasgos de comportamiento resultan ventajosos en un entorno amenazante, para evitar peligros innecesarios.
Este efecto se ha comprobado también en las personas. Por ejemplo, se ha visto que los niños que de pequeños han sufrido situaciones traumáticas repetidas, como acoso físico, psicológico o sexual, incorporan modificaciones epigenéticas en algunos genes que, de forma adaptativa, les hacen más resistentes a estas situaciones, pero que al alcanzar la edad adulta les hacen hiperreactivos a las situaciones de estrés y propician la manifestación de algunos trastornos cerebrales, como depresión, entre otros. Algunos de los genes que se ha visto que están implicados se relacionan con el cortisol, la vasopresina y la oxitocina, entre otras hormonas y neurohormonas.
«De vegades, les modificacions epigenètiques no es produeixen de manera programada, sinó que depenen de la interacció amb l’ambient»
También la alimentación y el estilo de vida influyen en las modificaciones epigenéticas. Por ejemplo, se ha visto que una dieta pobre en alimentos que contengan grupos químicos metilo y acetil, indispensables para generar las modificaciones epigenéticas necesarias, incrementa la predisposición a sufrir cáncer; que una dieta pobre en proteínas disminuye la metilación de algunos genes implicados en el metabolismo de los glícidos, las grasas y las proteínas, y propicia mecanismos inflamatorios; que el arroz integral contiene una molécula, denominada orizanol gamma, que incrementa la metilación del receptor DRD2 de la dopamina, un neurotransmisor implicado en los sentimientos de recompensa, el aprendizaje y el optimismo, y que también regula las modificaciones epigenéticas de genes que se expresan en el núcleo estriado del cerebro, una zona que gestiona la sensación de hambre, lo cual contribuye a disminuir la obesidad; que un consumo excesivo de grasas trans promueve modificaciones epigenéticas en genes del metabolismo que incrementan la probabilidad de tener obesidad y diabetes, y que algunas dietas equilibradas, como la mediterránea y la tradicional japonesa, contribuyen a un buen funcionamiento epigenómico, entre otros muchos casos estudiados.
También el humo del tabaco (Figura 4) altera las metilaciones de más de 700 genes, entre ellos genes supresores de tumores, relacionados con el sistema inmunitario y la detoxificación de sustancias oxidantes, lo cual explica el incremento de probabilidad de manifestar determinados tipo de cáncer, una mayor susceptibilidad a las infecciones y un envejecimiento más rápido. De manera similar, otras sustancias que causan adicción, como el cannabis, la cocaína y el alcohol, modifican el epigenoma de algunos genes relacionados con el funcionamiento cerebral, en aspectos como el sentimiento de recompensa y la generación y la regulación de las emociones, lo que ayuda a explicar los efectos a largo plazo de estas sustancias sobre el carácter y el comportamiento de las personas que las consumen.

Figura 4. Las sustancias que contiene el humo del tabaco alteran las metilaciones de más de 700 genes, entre ellos genes supresores de tumores, y otros relacionados con el sistema inmunitario y con la detoxificación de sustancias oxidantes, lo que repercute directamente en la salud de los fumadores. / Pixabay
Finalmente, por mencionar un par de ejemplos más entre los centenares que existen en la literatura científica, se ha visto que la práctica deportiva beneficia el epigenoma de como mínimo 12 genes diferentes, entre los cuales los hay implicados en la función cardíaca, en el metabolismo e incluso en la plasticidad cerebral. También el trabajo intelectual contribuye a establecer modificaciones epigenéticas que favorecen la plasticidad cerebral. E incluso la amistad contribuye a la formación de modificaciones epigenéticas en genes relacionados con la vasopresina, una neurohormona implicada en la gestión de las emociones de miedo y de ira, y en el establecimiento de relaciones sociales.
¿Se pueden transmitir a los hijos? ¿Hay que resucitar el lamarckismo?
Antes del experimento con el que he iniciado este artículo, el de los efectos sobre el epigenoma del sentimiento de abandono durante la niñez, la barbarie humana proporcionó uno de resultados completamente inesperados (Schulz, 2010). Durante el invierno de 1944 y 1945, las tropas nazis se batían en retirada en toda Europa, pero por motivos estratégicos y simbólicos se aferraban a conservar el noroeste de Holanda. Destruyeron las principales vías de comunicación terrestre e inundaron la mayor parte de campos de cultivo. Estos hechos coincidieron con un invierno especialmente frío, que heló los canales que se solían usar para transportar mercancías. La combinación de todos estos factores propició la que se ha conocido como «la hambruna holandesa». A finales de noviembre de 1944, la dieta de la mayor parte de los habitantes de las grandes ciudades holandesas se redujo a unas 1.000 calorías diarias, muy por debajo del óptimo, que se sitúa entre las 2.300 y 2.900 calorías diarias en los adultos activos. A finales de febrero de 1945, la disponibilidad de alimento había disminuido hasta el punto de proporcionar solo 580 calorías por día.
«Sustancias como el cannabis, la cocaína y el alcohol modifican el epigenoma de algunos genes relacionados con el funcionamiento cerebral»
Después de este episodio, el Gobierno holandés empezó a recopilar meticulosamente datos sobre la salud de todos los holandeses, tanto de los que habían sufrido el hambre con toda su crudeza como de los que vivían en zonas agrícolas donde había sido menos severa. Cuando se analizaron los datos, durante la década de 1970, se observó que las personas nacidas después de la hambruna cuyos padres la habían sufrido de adolescentes o de niños manifestaban una incidencia de obesidad que duplicaba los niveles normales, y tenían una probabilidad mucho más alta de manifestar trastornos psiquiátricos como esquizofrenia y depresión, y también de sufrir otras patologías como hipertensión, dolencias coronarias y diabetes de tipo 2.
El motivo, como se hizo evidente a principios de la década del 2000, es que tenían modificaciones epigenéticas en una serie de genes que, si bien los adaptaban a las condiciones severas del hambre, por ejemplo a través de la gestión del estrés, al mismo tiempo propiciaban los trastornos descritos. De alguna manera, los progenitores habían condicionado las modificaciones epigenéticas de sus descendientes todavía no concebidos, adaptándolos a lo que ellos habían sufrido, lo cual podría parecer que entronca directamente con la propuesta de Lamarck de la herencia de los caracteres adquiridos.
Aun así, no es este el caso, por dos motivos cruciales. Por un lado, estas modificaciones epigenéticas no alteran la secuencia del ADN, como sería necesario para considerar la herencia de los caracteres adquiridos. Solo afectan a la forma en que se regulan los genes, a través de modificaciones epigenéticas. Por otro lado, después de dos o como máximo tres generaciones, si no se mantienen las condiciones que las han propiciado (en este caso, el hambre), estas modificaciones epigenéticas dejan de transmitirse, y por tanto dejan de formar parte de la transmisión genética. Es únicamente un mecanismo de adaptación, que afecta a los individuos a nivel personal y en algunos casos a sus descendientes directos, como máximo hasta dos generaciones. Como dijo Darwin, «la naturaleza es compleja y adaptable». Es en este contexto, el de la adaptabilidad, donde hay que circunscribir la función biológica de las modificaciones epigenéticas.
«No solo se modifica nuestro epigenoma a través del estilo de vida que llevamos, sino que también podemos afectar al de nuestros hijos»
Corolario
La lección que nos dan todos estos datos es importante, dado que las modificaciones epigenéticas no solo afectan a cada individuo por él mismo según cómo sea su estilo de vida, sino que también implica una responsabilidad hacia las generaciones futuras. Se ha visto, por ejemplo, que el consumo de cannabis durante la adolescencia propicia modificaciones epigenéticas en los gametos que hacen que en el futuro los hijos que se pueda tener manifiesten una probabilidad más alta de padecer depresión y otras alteraciones emocionales durante su juventud y la edad adulta. Así pues, no solo se modifica nuestro epigenoma a través del estilo de vida que llevamos, sino que tambén podemos afectar al de nuestros hijos, a través del estilo de vida que les proporcionamos, e incluso el de los hijos todavía no concebidos.
David Bueno es autor del libro Epigenoma para cuidar tu cuerpo y tu vida (Plataforma Editorial, 2018).
REFERENCIAS
Champagne, F. A., Chretien, P., Stevenson, C. W., Zhang, T. Y., Gratton, A., & Meaney, M. J. (2004). Variations in nucleus accumbens dopamine associated with individual differences in material behavior in the rat. The Journal of Neuroscience, 24(17), 4113–4123. doi: 10.1523/JNEUROSCI. 5322-03.2004
Schulz, L. C. (2010). The Dutch Hunger Winter and the developmental origins of health and disease. PNAS, 107(39), 16757–16758. doi: 10.1073/pnas.1012911107





