
La cooperación es indispensable para la vida. Las células que componen nuestro cuerpo y el de todos los animales, plantas y hongos encuentran su origen en varios eventos de fusión cooperativa (endosimbiosis) entre células primitivas, hace unos 2.000 millones de años. Todos y cada uno de los organismos multicelulares que pisan, nadan o vuelan en este planeta, desde los diminutos ácaros que se alimentan del polvo que nos rodea a la colosal ballena azul, son (somos) resultado de la cooperación e integración entre células que, originalmente, eran entes individuales de vida libre. La más divertida de las formas de reproducción, la reproducción sexual, surge también de la cooperación entre los sexos, y la polinización de aproximadamente el 90 % de las plantas con flor, de la que dependen nuestros ecosistemas, descansa sobre la cooperación entre plantas y distintas especies de insectos. En definitiva, las grandes transiciones evolutivas, las sociedades animales y nuestros ecosistemas tal y como los conocemos se cimentan todos ellos en la existencia de cooperación. No obstante, en un mundo dominado por una competencia feroz por la supervivencia y la reproducción, la existencia de cooperación es, en sí misma, paradójica, y la pregunta «¿por qué cooperan los animales?» resuena hoy con más fuerza que nunca en biología.
«Todos y cada uno de los organismos multicelulares que pisan, nadan o vuelan en este planeta son resultado de la cooperación e integración entre células que, originariamente, eran entes individuales de vida libre»
En sentido evolutivo, la cooperación se define como una interacción entre dos organismos o entidades biológicas en la que tanto el actor como el receptor resultan beneficiados, ya sea directa (por medio de la descendencia propia) o indirectamente (por medio de la descendencia de familiares). Resulta especialmente enigmática la cooperación que se produce entre dos organismos (o células, o cualesquiera entidades biológicas que interaccionen) que no solo no se encuentran emparentados entre sí, sino que con frecuencia pertenecen a especies distintas. La naturaleza está plagada de estos casos, que denominamos en términos generales mutualismos. Por ejemplo, las bacterias en el intestino de las termitas que les permiten digerir celulosa a cambio de un ambiente nutritivo donde vivir; los peces limpiadores que se alimentan de los parásitos, mucus, crustáceos o tejido muerto de la piel de sus clientes para beneficio de ambos; o las hormigas del género Atta, que metódicamente recortan y acarrean hojas a su madriguera para alimentar los bosques de hongos que allí cultivan, y que propagarán a otras colonias a cambio de alimento. Pero, ¿cómo se mantienen estas alianzas? En cualquiera de los ejemplos anteriores, ¿qué pasaría si apareciesen individuos «egoístas» que se aprovechasen de los beneficios de la cooperación ahorrándose los costes de tener que hacerla recíproca? ¿Acaso no le interesaría más a un pez limpiador alimentarse también del tejido sano de su cliente? ¿O a una bacteria del intestino de una termita dejar de contribuir a la digestión de celulosa y aprovecharse de los recursos metabólicos de su hospedador? Las alianzas cooperativas permiten a ambos actores acceder a recursos que de otra forma no estarían disponibles, por eso probablemente se encuentre tan extendida la cooperación, pero ¿cómo logra la evolución conciliar el conflicto subyacente y evitar que las estrategias egoístas invadan y desmoronen el sistema?
De todos los tipos de alianzas que encontramos en la naturaleza, hay uno que ha sido y sigue siendo especialmente útil para abordar este tipo de cuestiones. Se trata de la conocida asociación entre hormigas y pulgones.
Pulgones y hormigas, una relación de amor-odio
Los pulgones son insectos chupadores que se alimentan del floema (savia elaborada) de las plantas. El floema constituye, a priori, una dieta desequilibrada por ser tan rica en azúcares como pobre en aminoácidos (los «ladrillos» a partir de los cuales se construyen las proteínas y, por ende, parte indispensable de la dieta de un animal). Ello hace que, para cubrir sus necesidades de aminoácidos, los pulgones deban ingerir grandes cantidades de floema, lo que genera un exceso de azúcares que es excretado por el ano en forma de gotitas de melaza. La naturaleza rara vez desperdicia recursos tan preciosos como estos, así que las deliciosas gotitas de melaza son aprovechadas con frecuencia por algunas especies de hormigas, constituyendo la base de las asociaciones de tipo mutualista descritas entre pulgones y hormigas (trofobiosis). Cual vacas de seis patas, las hormigas «ordeñan» la melaza de los pulgones que, a cambio, reciben protección frente a los depredadores y un exhaustivo «servicio de limpieza» por parte de las hormigas que los atienden, lo que aumenta drásticamente las probabilidades de supervivencia y reproducción de las colonias de pulgones.
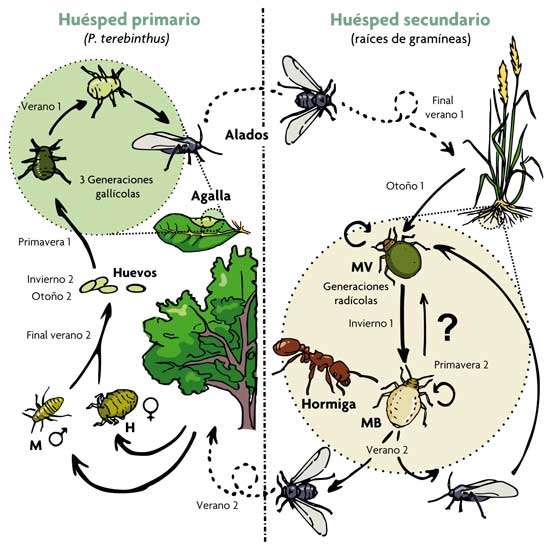
Figura 1. Esquema simplificado del ciclo de vida bienal del pulgón Paracletus cimiciformis. La fase sexual tiene lugar en el huésped primario (arbustos de Pistacia terebinthus). Allí se producen hasta cinco morfos diferentes. De ellos, tres son partenogenéticos y se desarrollan dentro de unas agallas muy características que inducen en las hojas de su anfitrión. Hacia el final del verano, la última generación nacida en el interior de las agallas consiste en pulgones alados que vuelan y colonizan las raíces de varias especies de gramíneas (huésped secundario). Allí inician una serie de generaciones partenogenéticas ápteras (sin alas) formadas por uno o ambos de los dos morfos alternativos: el morfo verde (MV) y el morfo blanco (MB). Estos dos morfos interaccionan de manera muy distinta con hormigas del género Tetramorium. Al final del verano, se producen dos morfos alados indistinguibles que dispersan el clon a nuevas gramíneas o regresan a Pistacia, dando lugar a una nueva generación sexual. El signo de interrogación indica que no se conocen con detalle los factores que controlan la producción de uno u otro morfo. M, macho; H, hembra sexual. / Salazar, A., Fürstenau, B., Quero, C., Pérez-Hidalgo, N., Carazo, P., Font, E. & Martínez-Torres, D. (2015). Agressive mimicry coexists with mutualism in an aphid. PNAS, 112, 1101-1106. doi: 10.1073/pnas.1414061112
Aunque la descripción anterior constituye el paradigma comúnmente utilizado para presentar las interacciones entre pulgones y hormigas, la realidad, como casi siempre, es más compleja. De hecho, existe todo un abanico de interacciones entre pulgones y hormigas que van desde el mutualismo más estricto al más puro antagonismo. Así, algunas hormigas combinan el cuidado de los pulgones con su depredación (es decir, «cosechan» tanto la melaza producida por los pulgones que atienden como, eventualmente y en algunos casos, a los propios pulgones), mientras que otras solo son depredadoras. Por su parte, de las aproximadamente 4.000 especies conocidas de pulgones, solo alrededor de una cuarta parte participan en este tipo de interacciones mientras que la mayoría nunca establecen asociaciones con hormigas. Además, aunque existen numerosos ejemplos de pulgones mirmecófilos obligados (que solo se pueden desarrollar bajo la protección de las hormigas), la mayoría de asociaciones descritas entre pulgones y hormigas son de carácter facultativo (oportunista). En este sentido, diferentes estudios sobre la distribución filogenética de la mirmecofilia en pulgones sugieren que las asociaciones entre pulgones y hormigas son evolutivamente inestables, formándose y rompiéndose en función de un complejo balance entre costes y beneficios para los participantes que aún no comprendemos bien. En definitiva, las interacciones pulgón-hormiga constituyen una relación de amor odio a nivel evolutivo, y por tanto un sistema ideal para estudiar los mecanismos y los factores que regulan la cooperación.
«Las interacciones pulgón-hormiga constituyen una relación de amor-odio a escala evolutiva, y por tanto un sistema ideal para estudiar los mecanismo y los factores que regulan la cooperación»
‘Paracletus cimiciformis’, dos pulgones en uno
Como el resto de especies de su grupo, Paracletus cimiciformis (el verdadero protagonista de este artículo) presenta un ciclo biológico de los más complejos descritos en pulgones (figura 1). Mientras que una parte de su ciclo se desarrolla sobre hojas de terebinto (Pistacia terebinthus), otra parte tiene lugar sobre las raíces de diferentes gramíneas (fase radicícola) y supone una oportunidad para establecer contacto con hormigas y llegar a algún tipo de «acuerdo» de cooperación. Durante más de 180 años, desde su descripción en 1837, solo se conoció un único tipo de pulgón (lo que llamamos un «morfo») sin alas para la fase radicícola de esta especie: un morfo de coloración blanquecina y con forma de chinche (de ahí su nombre cimici, que en italiano significa ‘chinches’), del que se enfatizaba su obligada asociación con hormigas, principalmente del género Tetramorium. No obstante, en 2010 un estudio llevado a cabo en las universidades de Valencia y León (liderado por David Martínez, coautor de este artículo) demostró que la fase radicícola de esta especie incluye un segundo morfo sin alas, abombado y de color verde, que hasta entonces había sido clasificado por los expertos como una especie diferente de pulgón perteneciente a otro género (figura 2). Este estudio demostró, además, que los pulgones de ambos morfos (verde y blanco) pueden dar lugar a pulgones del mismo o del otro morfo por reproducción asexual y que, por tanto, son genéticamente idénticos. Además de contribuir a mejorar nuestro conocimiento del ciclo biológico de P. cimiciformis y resolver un error taxonómico arrastrado a lo largo de casi dos siglos, este hallazgo nos obligó a plantearnos una pregunta obvia: ¿por qué dos morfos?

Figura 2. Imágenes de dos pulgones adultos correspondientes al a) morfo blanco y b) al morfo verde de la fase radicícola de P. cimiciformis. Además de la diferente coloración, ambos morfos se distinguen en el número de piezas de las antenas (seis en el morfo blanco y cinco en el verde) y en la forma de las tibias traseras (curvadas y rectas, respectivamente). / Carlos del Pico
Las dos caras de ‘P. cimiciformis’: Dr. Jekyll y Mr. Hyde
En un reciente estudio multidisciplinar coordinado desde la Universitat de València (liderado por David Martínez y su estudiante de doctorado Adrián Salazar), nos propusimos resolver este enigma investigando con detalle las interacciones entre las hormigas del género Tetramorium y los pulgones de los morfos verde y blanco de P. cimiciformis. Los resultados –que se recogen en el artículo «Aggressive mimicry coexists with mutualism in an aphid», publicado en enero de 2015 por la revista PNAS (Proceedings of the National Academy of Sciences of the United States of America)– fueron sorprendentes y suponen el descubrimiento de una relación hasta la fecha desconocida entre pulgones y hormigas, y en general en la naturaleza: un sorprendente (¡y real!) caso de Dr. Jekyll y Mr. Hyde.
Por un lado, los pulgones del morfo verde (nuestro particular Dr. Jekyll) mantienen con las hormigas una relación típica de trofobiosis (figura 3a). En contraposición, el morfo blanco se comporta como un auténtico Mr. Hyde. Cuando las hormigas se aproximan a los pulgones blancos, se inicia una serie de acontecimientos bien distintos a una secuencia trofobióntica. Este particular baile comienza con las hormigas palpando a los pulgones blancos suavemente con sus antenas, como reconociéndolos, a lo que estos reaccionan retrayendo sus patas y permaneciendo inmóviles. Entonces, las hormigas los cogen con cuidado entre sus mandíbulas y los transportan a su cámara de cría, el lugar más protegido e impenetrable del hormiguero, donde los depositan junto a sus propias larvas. Una vez allí, los pulgones blancos son acicalados y atendidos continuamente por las obreras del mismo modo que hacen con sus propias larvas. Tal es el grado de integración de los pulgones blancos en la cámara de cría de las hormigas que cuesta distinguirlos a simple vista de las larvas de hormiga que los rodean (figura 3b). A todas luces, los pulgones del morfo blanco son confundidos por las hormigas con sus propias larvas, y su comportamiento hacia ellos resulta prácticamente indistinguible del que tienen con sus larvas. De alguna forma, los pulgones blancos imitan a las larvas de las hormigas y consiguen que estas los adopten (literalmente).
«Hay todo un abanico de interacciones entre pulgones y hormigas que van desde el mutualismo más estrico al más puro antagonismo»
¿Por qué? ¿Cuál es el sentido de un morfo cuyo único objetivo aparente es hacerse transportar hasta la cámara de cría de las hormigas? Las recurrentes observaciones de pulgones blancos con sus estiletes clavados en las turgentes larvas de las hormigas no dejaron lugar a dudas: lo que estos aparentemente inocentes pulgones blancos hacen en la cámara de cría es succionar la hemolinfa (la sangre de los insectos) de las larvas de las hormigas (figura 3c y 3d). Para vencer nuestro inicial (y sano) escepticismo, buscamos ADN específico de hormiga en el interior de los pulgones blancos con y sin acceso a la cámara de cría y solo lo encontramos en aquellos pulgones que habían accedido a la cámara, dejando claro que estos pulgones «vampiro» se estaban nutriendo de las larvas de las mismas hormigas que los estaban adoptando. Esto no solo supone el primer caso conocido de un pulgón carnívoro (hasta ahora considerados como estrictamente vegetarianos), sino el primer caso en el que, por medio de dos morfos (en este caso además genéticamente idénticos), una misma especie se comporta a la vez como mutualista y como depredador. Los dos morfos radicícolas (el cooperativo morfo verde, que ofrece su melaza a las hormigas, y el agresivo morfo blanco, que engaña y chupa la sangre de las larvas de las hormigas) representan así las dos caras de una misma moneda, o los Dr. Jekyll y Mr. Hyde de un mismo pulgón: P. cimiciformis.
La pregunta siguiente: la base del engaño
Una vez descrito el fenómeno, la pregunta a responder era: «¿Cómo? ¿Cómo logran engañar los pulgones blancos a las hormigas?». Se sabe desde hace tiempo que el principal modo de comunicación en las hormigas es de tipo químico, gracias a receptores presentes en sus antenas que les permiten detectar moléculas de feromonas u otras sustancias presentes en el aire o en el sustrato. Más concretamente, se sabe que los hidrocarburos presentes en la cutícula (la piel de los insectos) de las hormigas representan un papel esencial en el reconocimiento de miembros de su misma especie y colonia, e incluso en la distinción entre castas de un mismo hormiguero. Nos preguntamos, por tanto, si los pulgones blancos no podrían estar imitando los hidrocarburos cuticulares de las larvas de hormiga, utilizándolos como un «disfraz de cordero» con que ocultar su verdadera naturaleza de lobo.
«En un mundo dominado por una competencia feroz por la supervivencia y la reproducción, la existencia de cooperación es, en sí misma, paradójica»
En una serie de experimentos realizados en completa oscuridad, permitimos a las hormigas el acceso a una mezcla de pulgones del morfo blanco y del morfo verde de P. cimiciformis. Las hormigas solo adoptaron pulgones del morfo blanco, por lo que descartamos que la discriminación entre ambos morfos fuese visual. En una segunda tanda de experimentos realizamos extractos de cutícula de pulgones blancos, de pulgones verdes y de las propias larvas de las hormigas y los utilizamos para impregnar pedacitos de plástico que luego ofrecimos a las hormigas. Éstas solo se llevaron a su cámara de cría aquellos que habían sido impregnados con extractos de sus propias larvas o de pulgones del morfo blanco, lo que apuntaba claramente a que las hormigas confunden el «olor» del morfo blanco de P. cimiciformis con el de sus propias larvas. Finalmente, un análisis químico detallado, mediante cromatografía de gases, reveló que la composición en hidrocarburos cuticulares de los pulgones del morfo blanco era, globalmente, más parecida a la de las larvas de las hormigas que a la de sus hermanos (¡genéticamente idénticos!) del morfo verde, lo que demostraba la naturaleza química del mimetismo desarrollado por el morfo blanco de P. cimiciformis.
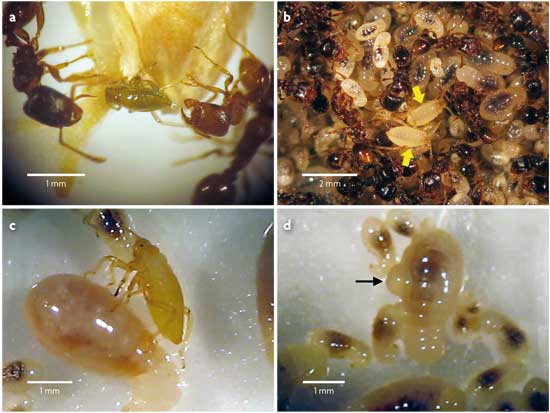
Figura 3. Imágenes representativas de las interacciones entre los dos morfos de P. cimiciformis y hormigas del género Tetramorium: a) interacción clásica de tipo trofobióntico entre el morfo verde (que ofrece su gota de melaza) y las hormigas; b) resultado de la adopción de pulgones del morfo blanco por las hormigas; la similar coloración que presenta el morfo blanco y las larvas de las hormigas hace a los pulgones casi indistinguibles entre el montón de larvas de hormiga; c) Mr. Hyde en acción: pulgón blanco con su estilete clavado en una larva de hormiga, succionando su hemolinfa, y d) gota de hemolinfa en una larva recién perforada. / Salazar, A., Fürstenau, B., Quero, C., Pérez-Hidalgo, N., Carazo, P., Font, E. & Martínez-Torres, D. (2015). Agressive mimicry coexists with mutualism in an aphid. PNAS, 112, 1101-1106. doi: 10.1073/pnas.1414061112
Más y más y más preguntas… El camino por recorrer
La descripción de esta asociación sin precedentes entre pulgones y hormigas genera, sin duda, una serie de nuevas preguntas a las que habrá que ir dando respuesta. ¿Cuáles son los beneficios para el pulgón P. cimiciformis de complicar, más si cabe, su ciclo biológico introduciendo en él un morfo agresivo? ¿Cómo de amplio es el engaño entre las distintas poblaciones o especies de hormigas potencialmente víctimas? ¿Hasta dónde llega el engaño para las hormigas (conviene tener en cuenta que los pulgones blancos producen eventualmente pulgones verdes que ofrecen melaza a las hormigas, y que por tanto las benefician)? Si el coste neto es elevado para las hormigas, ¿se encuentran pulgones y hormigas en medio de una carrera evolutiva, las unas aumentando su capacidad de discriminación para evitar el engaño y los otros «disfrazándose» cada vez mejor para conseguir sus propósitos?
En cualquier caso, el recién descubierto sistema P. cimiciformis-hormigas se encuentra en la interfase misma entre la cooperación y el engaño y supone, por tanto, una ocasión inmejorable para abordar el estudio de numerosos aspectos sobre el origen y evolución de la cooperación y de la explotación. Además, el hecho sin precedentes de que dos estrategias evolutivas ubicadas en extremos opuestos de un continuo teórico, que van desde el mutualismo (el morfo verde) hasta la explotación (el morfo blanco), coexistan en una misma especie y en un mismo genotipo, resulta tan sorprendente como enigmático, tan novedoso como excitante. ¿Tendrán otros aparentemente inocentes Dr. Jekyll ahí fuera en la naturaleza un malvado gemelo Mr. Hyde?
Explicando el altruismo: Hamilton y la selección por parentesco
[El problema de l’altruisme és] especialment difícil, em semblava en un principi insuperable, i de fet fatal per a tota la meua teoria.
Charles Darwin, El origen de las especies, 1859
Las ardillas terrestres de Belding (Spermo–phi-lus beldingi) viven en grupos sociales en las praderas del oeste de los Estados Unidos. Cuando un depredador se acerca a su grupo social, en ocasiones uno de sus individuos emite una vocalización o «llamada de alarma» que alerta a las demás ardillas, que buscarán refugio rápidamente. Tras más de catorce años de observaciones, Paul Sherman y sus colaboradores pudieron calcular que las probabilidades de que una ardilla que detecta un depredador terrestre sea capturada son de aproximadamente un 8% cuando esta emite una señal de alarma, y tan solo de un 4% cuando la ardilla no emite señal alguna. Como él mismo reconoció, este y muchos otros ejemplos similares de altruismo, donde un organismo sacrifica parte de su eficacia biológica en beneficio de otro, constituyeron una paradoja central para la teoría de la selección natural de Darwin desde el mismo instante en que se publicó El origen de las especies en 1859. ¿Cómo podía la selección natural dar lugar a comportamientos que disminuían la eficacia biológica de un individuo?
«La descripción de esta asociación sin precedentes entre pulgones y hormigas genera, sin duda, una serie de nuevas preguntas a las que habrá que ir dando respuesta»
Tendríamos que esperar hasta 1964 para conocer la respuesta, cuando William D. Hamilton sentó las bases de la «selección por parentesco», una de las teorías más exitosas de la biología evolutiva. Utilizando modelos matemáticos, Hamilton puso de manifiesto que la evolución puede favorecer estos comportamientos altruistas, y la cooperación en general, cuando estos tienen un efecto positivo sobre la descendencia de sus parientes. Dado que dos individuos emparentados tenderán a portar los mismos genes, un comportamiento altruista incrementará de forma indirecta el número de copias de sus genes que se propagan a la siguiente generación, y por tanto puede resultar beneficioso en términos evolutivos. De ahí la célebre frase del biólogo evolutivo J. B. S. Haldane quien, ante la pregunta de si sacrificaría su vida por un hermano, contestó sin tapujos que no dudaría en sacrificar su vida siempre que fuese por la vida de dos hermanos, u ocho primos. Dado que dos hermanos comparten en promedio un 50% de sus genes, un organismo «altruista» que sacrificase su propia descendencia por la de dos hermanos (u ocho primos, con los que comparte el 12,5% de sus genes) tendría el mismo éxito reproductivo que uno «egoísta» que no se sacrificase. En sentido coloquial, ambos son igual de egoístas ya que ambos están maximizando su propia eficacia biológica, si bien por medio de estrategias distintas.





