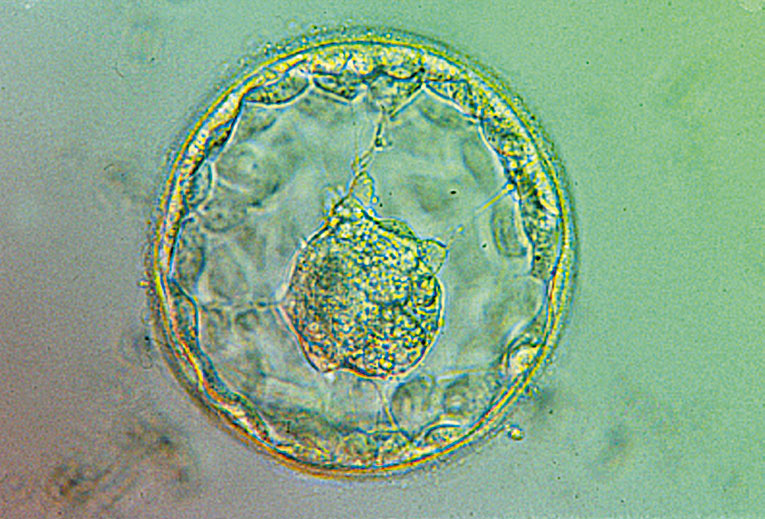

Blastocisto expandido. En el centro se aprecia la masa celular interna (MCI). |
||
|
Embryonary stem cells and Regenerative Medicine. Embryonary stem cells have represented a scientific revolution in recent years given their potential capacity to turn into any cell type in the organism. Their therapeutic importance lies in the fact that they can be useful for treating diseases caused by a deficit in cell functioning. Numerous research groups world-wide are working to find out the differentiation mechanisms, as well as alternative techniques to using pre-embryos, in order to discover a safe and efficient therapy for these types of illness. Las células madre (CM) son células indiferenciadas que pueden encontrarse en embriones (CM embrionarias), algunos tejidos fetales, cordón umbilical, placenta (CM fetales) y en tejidos adultos (CM adultas). Son células pluri o multipotentes (en algunos casos totipotentes) que pueden dar lugar a distintos tipos celulares, dependiendo de su origen y plasticidad. La investigación en células madre es una herramienta de gran utilidad para el descubrimiento de nuevos fármacos, para el estudio del desarrollo y control génico y también en terapias de patologías debidas a pérdida de función celular. La terapia celular, a través del trasplante de células madre diferenciadas en distintos tipos celulares, puede representar una alternativa terapéutica en enfermedades tales como algunas alteraciones neurodegenerativas, accidentes vasculares, lesiones de médula espinal, insuficiencia cardíaca y la diabetes juvenil, entre otras. Centrándonos en las células madre embrionarias (CME), conviene recordar algunas fechas determinantes en este área de investigación convertida hoy en día en una de las más novedosas y que experimenta avances extremadamente rápidos y espectaculares. En el año 1978 nace en el Reino Unido el primer individuo de la especie humana resultante de una fecundación in vitro (Edwards y Steptoe, 1978). Veinte años más tarde, se publica la obtención de células madre embrionarias a partir de preembriones humanos sobrantes de procesos de reproducción asistida (Thomson et al, 1998). Desde entonces, las publicaciones científicas relacionadas con este ámbito no han dejado de incrementarse. |
«La investigación en células madre es una de las más innovadoras, experimenta avances extremadamente rápidos y espectaculares» | |
 Colònia de cèl·lules mare embrionàries (CME). |
«Las células madre embrionarias poseen una gran capacidad de proliferación y por tanto hay que valorar el riesgo de producir tumores antes de ser trasplantadas» | |
|
Las células madre embrionarias proceden de la masa celular interna de blastocistos. Se trata de preembriones de cinco o seis días con aproximadamente 150-200 células. La masa celular interna, origen de las CME en condiciones de cultivo in vitro, es la que daría lugar al feto en condiciones in vivo, si el preembrión se implantara y la gestación llegara a término. El cultivo de esta estructura da lugar al crecimiento de las CME. Este tipo de células poseen unas características específicas a causa de su capacidad de autorrenovación indefinida y a su pluripotencialidad. Las CME pueden dar lugar a nuevas células madre indiferenciadas o convertirse en distintos tipos celulares de los más de 200 que existen en un individuo adulto de la especie humana. La investigación en CME avanza rápidamente pero los factores genéticos y ambientales que controlan tanto su estado indiferenciado como los procesos que permiten la diferenciación en distintos tipos celulares no están completamente establecidos. Los distintos grupos que investigan en este ámbito intentan determinar qué condiciones de cultivo propician el estado indiferenciado y cuáles provocan determinados tipos de diferenciación. La identificación y caracterización de los mecanismos genéticos, epigenéticos y celulares responsables de mantener el estado indiferenciado de las CME y de dirigir su diferenciación hacia tipos celulares específicos es un área de investigación en la que se producen continuos avances. La terapia celular consiste en el trasplante de células diferenciadas a partir de CM y está destinada a reparar tejidos en los que se ha perdido la funcionalidad de las células. Es importante tener en cuenta, a la hora de plantear posibilidades terapéuticas, que las CME poseen una gran capacidad de proliferación y que, por tanto, hay que valorar el riesgo de producir tumores antes de ser trasplantadas. Se ha demostrado ya el potencial de estas células para diferenciarse en diversos tipos celulares y su funcionalidad cuando son ser injertadas en modelos animales tales como el ratón. Parece que los primeros ensayos en humanos podrían llevarse a cabo en un futuro muy próximo. En la especie humana se ha obtenido ya diferenciación en células de músculo cardíaco, células neuronales, células hematopoyéticas, células pancreáticas, células endoteliales, hepatocitos y trofectodermo. Es imprescindible poder controlar y dirigir la diferenciación celular y obtener poblaciones puras de células diferenciadas para plantear una terapia sin riesgo para el paciente y con posibilidades de éxito. Numerosos grupos en Europa (Reino Unido, Suecia, Dinamarca, Finlandia, España, Francia) y en el resto del mundo (EEUU, Israel, China, Corea del Sur, Singapur, India, Australia) están derivando actualmente líneas de CME a partir de blastocistos obtenidos de preembriones sobrantes de programas de fecundación in vitro. La investigación encaminada en comprender los mecanismos que controlan la autorrenovación y la pluripotencialidad se lleva a cabo en aquellos países en los que la legislación permite la investigación con preembriones humanos y con células madre embrionarias. España se encuentra entre los países en los que se permite realizar este tipo de investigaciones. Las leyes 14/2006 y 14/2007 de Técnicas de Reprodución Asistida y Biomedicina, respectivamente, establecen el marco legal en nuestro país y regulan la investigación con material embrionario, permitiendo la utilización de técnicas tales como la transferencia nuclear y la partenogénesis para la obtención de CME. |
||
 Distintos tipos celulares: A. Presencia de beta-tubulina tras la diferenciación inducida de células madre a ectodermo (neurona). B. Presencia de alfa-actinina tras la diferenciación inducida de células madre a mesodermo (cardiomiocito). C. Presencia de alfa-fetoproteína tras la diferenciación espontánea de células madre a endodermo (tejido glandular). |
«El trasplante con células obtenidas a partir de un pre-embrión clonado del propio paciente evitaría problemas de rechazo inmunológico» | |
|
La mayoría de las líneas de CME obtenidas hasta hoy proceden de preembriones de los programas de fecundación in vitro, donados por parejas que ya no los desean utilizar con fines reproductivos y que optan por destinarlos a investigación. La calidad de los preembriones utilizados parece ser un factor clave a la hora de optimizar el proceso. La utilización de preembriones cromosómicamente anormales y portadores de enfermedades puede ser de utilidad como modelos de patologías diversas. Se han publicado hasta la fecha aproximadamente 200 líneas de CME, con distintas metodologías (Veiga et al., 2007). La metodología de obtención de las CME implica actualmente el uso de algunos productos de origen animal, aunque determinados protocolos descritos recientemente evitan este tipo de sustancias. El objetivo es la derivación de líneas de CME en condiciones definidas, sin productos de origen animal y en condiciones de good manufacturing practice (GMP), necesarias o en todo caso muy recomendables para plantear terapias de aplicación clínica. Se están estableciendo registros y bancos de células madre y es importante que se disponga de toda la información relativa a las líneas de CME existentes y en utilización, sobre todo en cuanto a las características de la metodología de obtención y a sus propiedades de diferenciación. El Registro Europeo de Líneas de CME (EU hESC Registry), proyecto financiado por la Comisión Europea ( FP6) en el que colaboran el Centro de Medicina Regenerativa de Barcelona y el Berlin Centre for Regenerative Therapies, constituye una herramienta imprescindible para los investigadores de este campo. Los problemas técnicos que existen hoy en día para plantear la aplicación clínica de terapia celular hacen necesaria la investigación en profundidad para elucidar los mecanismos que controlan la diferenciación, la desdiferenciación y la transdiferenciación. Hay que controlar el crecimiento, la migración, el destino y la diferenciación celular para asegurar procesos estables tras el trasplante de las células. El rechazo inmunológico es otro de los problemas a resolver y se están estudiando distintas fórmulas para evitarlo, o al menos disminuir sus efectos. Entre ellas cabe destacar el uso de fármacos inmunosupresores, el uso de células HLA compatibles en el trasplante y la inducción de inmunotolerancia mediante administración previa de material embrionario o hematológico del donante. Otra de las opciones es la obtención de CME procedentes de preembriones clonados mediante transferencia nuclear. Esta técnica, también conocida como clonación terapéutica, requiere la misma metodología que la descrita por Wilmut y colaboradores en 1997 para el nacimiento de la oveja Dolly. Se trata de la transferencia del núcleo de una célula somática a un ovocito del cual se ha eliminado el núcleo. La finalidad de la clonación terapéutica no es reproductiva, como en el caso de Dolly, sino la obtención de preembriones clonados con los que derivar células madre embrionarias. El trasplante con células obtenidas a partir de un preembrión clonado del propio paciente evitaría la aparición de problemas de rechazo inmunológico. Por otra parte, esta técnica constituye una herramienta muy útil para conocer los mecanismos celulares y moleculares de determinadas enfermedades y poder estudiar pautas de tratamiento. La derivación de CME a partir de preembriones obtenidos por transferencia nuclear ya ha sido llevada a cabo con éxito en el ratón y otros modelos animales, aunque no se ha conseguido todavía en la especie humana. Existe actualmente un amplio abanico de técnicas que permiten la obtención de CME, con ventajas e inconvenientes inherentes a su utilización que las hacen más o menos reproducibles y aplicables (Green, 2007). Distintos grupos también han descrito recientemente la posibilidad de convertir en células pluripotentes distintos tipos celulares mediante reprogramación celular, evitando en este caso la utilización de preembriones. El Banco de Líneas Celulares del Centro de Medicina Regenerativa de Barcelona inició su actividad en julio de 2005, con el proyecto «Derivación de células madre embrionarias en condiciones libres de xenobióticos y caracterización in vivo de su pluripotencialidad». Hasta el momento se han obtenido cinco líneas de CME, dos de las cuales han sido ya depositadas en el Banco Nacional de Líneas Celulares, tras ser exhaustivamente caracterizadas fenotípica y genéticamente. El objetivo a alcanzar es la eliminación de productos de origen animal en el proceso de derivación así como la utilización de protocolos GMP para hacer posible la utilización de estas células en terapia celular. BIBLIOGRAFÍA Anna Veiga, Begoña Aran, Ignasi Rodríguez, Ángel Raya i Juan Carlos Izpisúa Belmonte.Banco de Líneas Celulares. Centro de Medicina Regenerativa de Barcelona. |
||





