La evolución del cerebro humano
Cómo el aumento de la plasticidad cerebral nos convirtió en una especie cultural
¿Por qué los humanos son tan diferentes de otras especies de primates? ¿Qué nos hace tan aptos para crear lenguajes, arte y música? Las especializaciones en la anatomía del cerebro humano, responsables de nuestros rasgos cognitivos y conductuales únicos, han evolucionado en un periodo de tiempo evolutivo muy corto (entre seis y ocho millones de años). Evidencias recientes sugieren que, junto con un aumento en el tamaño y la reorganización del cerebro, la plasticidad cerebral también puede tener un papel importante en la historia evolutiva de nuestra especie. La plasticidad es la propensión del cerebro a ser moldeado por influencias externas, incluyendo el contexto ecológico, social y cultural. El impacto de estas influencias ambientales sobre el desarrollo del comportamiento humano se conoce desde hace tiempo, pero solo recientemente los científicos han comenzado a descubrir que el cerebro humano es más plástico que los de nuestros parientes cercanos.
Palabras clave: genes, ambiente, desarrollo, altricialidad, epigenética.
Introducción
Los humanos y los chimpancés son sorprendentemente similares en términos genéticos. Comparten cerca del 98 % de secuencias codificantes de ADN. Además, los humanos y los chimpancés comparten la mayor parte de su historia evolutiva. Solo divergieron hace entre seis y ocho millones de años. Esta proximidad genética y evolutiva contrasta notablemente con las claras diferencias conductuales y cognitivas entre los humanos y los chimpancés, nuestros parientes vivos más cercanos junto a los bonobos. Estas diferencias se basan en modificaciones anatómicas que han evolucionado tras la divergencia entre chimpancés y humanos a partir de su antepasado común. Sin embargo, los cerebros no fosilizan, por lo que resulta difícil estudiar la evolución cerebral en especies de homininos fósiles. Para evitar este problema, los científicos pueden comparar los cerebros humanos y los de chimpancés y otros animales para profundizar en las características cerebrales que hacen única a nuestra especie.
«El tamaño del cerebro en los neonatos humanos representa tan solo una cuarta parte del tamaño del cerebro de un adulto, mientras que en chimpancés y orangutanes es aproximadamente una tercera parte»
Tales estudios se han centrado en el tamaño y la reorganización del cerebro, y destacan que la evolución humana se caracterizó por la triplicación del tamaño del cerebro y por una expansión desmesurada de las áreas de asociación frontal y parietal del córtex cerebral (figura 1). Sin embargo, estudios más recientes se han centrado en otras propiedades del cerebro. Entre ellas, consideramos que la plasticidad es especialmente importante porque confiere a los individuos la habilidad de adaptarse a entornos concretos y ofrece una base para los procesos de evolución conductual y cultural que son tan importantes para nuestra especie. En este artículo hemos revisado y sintetizado la evidencia disponible sobre la evolución de la plasticidad del cerebro en humanos, centrándonos en estudios comparativos de humanos y chimpancés y en la evaluación del registro fósil de homininos, incluyendo la evidencia paleontológica y los datos paleogenéticos.
Estudios compatarivos de la evolución de la plasticidad del desarrollo
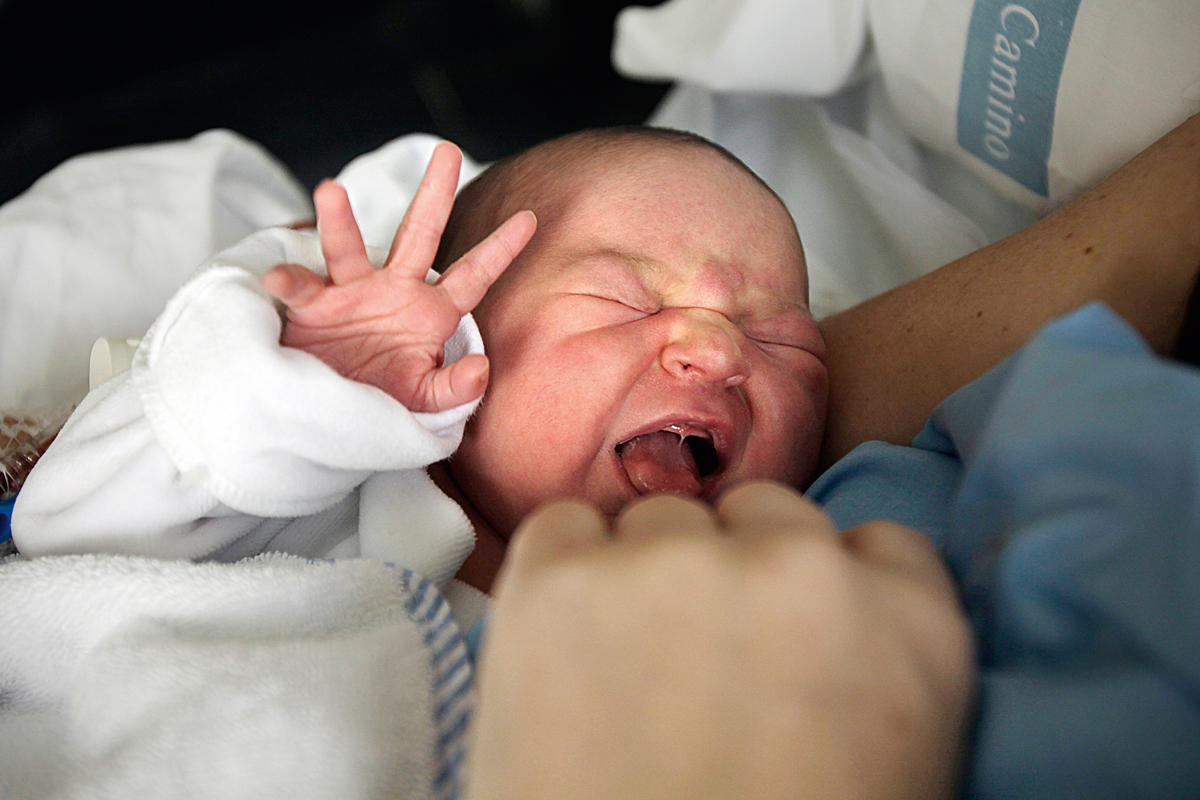
En comparación con otros mamíferos, el ritmo de desarrollo de los primates se considera relativamente precoz; es decir, las crías nacen tras un largo periodo de gestación con unas conductas y una movilidad relativamente avanzadas y maduras (figura 2). No obstante, los humanos somos secundariamente altriciales (Portmann, 1969), lo cual significa que nacemos en un estado relativamente inmaduro en comparación con otros primates. La altricialidad es evidente en humanos en cuanto que la independencia de las crías es relativamente lenta y requieren una mayor atención y cuidado parental (figura 3). Este subdesarrollo neonatal inicial se puede medir de acuerdo a diferentes variables. La duración de la gestación en humanos es de aproximadamente 270 días, muy similar a la duración de la gestación observada en gorilas y orangutanes (265 y 270 días respectivamente) y seis semanas más larga que el periodo correspondiente en chimpancés (230 días) (Sacher y Staffeldt, 1974).
En términos absolutos, los neonatos humanos son alrededor de dos veces más grandes que los simios, lo que incluye tanto el tamaño corporal como el cerebral (tabla 1). Por lo tanto, la afirmación de que los humanos son secundariamente altriciales no se basa en la duración de la gestación o el tamaño absoluto del cuerpo o el cerebro. La media del peso corporal de los humanos neonatos es un 5,6 % del peso corporal adulto, que también es mayor en comparación con la proporción observada en los grandes simios: 3,4 % en chimpancés, 1,2 % en gorilas y 4,1 % en orangutanes, de acuerdo a los datos de Sacher y Staffeldt (1974). Por el contrario, el tamaño del cerebro en los neonatos humanos representa solo una cuarta parte del tamaño del cerebro de un adulto, mientras que en chimpancés y orangutanes el tamaño del cerebro de los neonatos es aproximadamente una tercera parte del tamaño del cerebro de un adulto, y los gorilas nacen con un cerebro de aproximadamente la mitad de su volumen adulto (tabla 1).
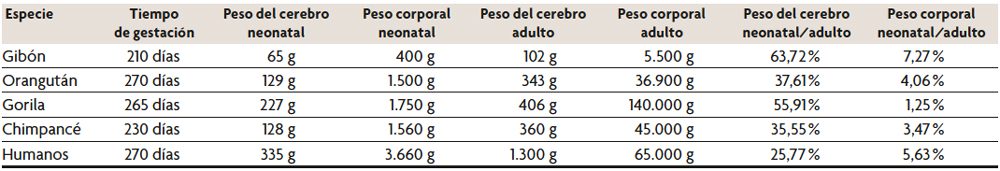
Mesa 1. Variación en el peso corporal y cerebral entre simios neonatos y adultos.
La altricialidad en el tamaño relativo del cerebro queda reflejada también en características neurológicas y de comportamiento, que tampoco están maduras en los humanos al nacer (Portmann, 1969). En términos anatómicos, se ha demostrado que los patrones principales de surcos (el patrón de repliegues característico del cerebro) ya están establecidos al nacer, pero los surcos secundarios y terciarios, que están relacionados con patrones regionales de expansión cortical, continúan su formación después del nacimiento (Hill et al., 2010). A nivel microestructural, la mayor parte del proceso de neurogénesis (la producción de neuronas) y de migración cortical está completo al nacer, por lo que la estructura laminar típica del córtex cerebral está establecida al término del embarazo. Las primeras conexiones sinápticas se forman durante el primer trimestre de desarrollo prenatal, pero son conexiones transitorias que más adelante darán lugar a circuitos maduros (Tau y Peterson, 2009).
En el momento del nacimiento, la arborización dendrítica y la sinaptogénesis (la formación de sinapsis o conexiones entre neuronas), que más tarde se extenderán durante el periodo inicial de la vida postnatal, se producen a la máxima velocidad. El exceso de neuronas y de conexiones sinápticas formadas durante el desarrollo temprano se eliminará más tarde mediante un proceso de «poda». La poda sináptica y neuronal es en esencia una reorganización de los circuitos locales y de asociación que facilita la integración de información entre dominios corticales. La mielinización, el proceso por el cual las células gliales envuelven a los axones de las neuronas para formar múltiples capas de membrana celular glial, aumenta la velocidad y fidelidad con la que se transmite información. También es esencial para permitir la sincronización de la actividad neuronal en el procesamiento sensorial y la cognición. En el momento en que nacen los humanos, el tejido cerebral predominante es la materia blanca sin mielinizar y la proporción del volumen total del cerebro que contiene materia blanca mielinizada es tan sólo de un 5 % (Tau y Peterson, 2009). El desarrollo altricial de nuestra especie implica que el establecimiento temprano de la conectividad ocurre durante un periodo crítico en el que estamos expuestos a una gran variabilidad social y ambiental. Esto podría ser especialmente importante para alcanzar hitos de desarrollo que típicamente ocurren en el periodo inicial de la vida, como las primeras palabras.
«Los análisis de grandes muestras de resonancias magnéticas de cerebros humanos y de chimpancés han demostrado que la organización cortical no tienen una fuerte determinación genética en humanos, como sí que ocurre en chimpancés»
Diversos estudios comparativos han descrito diferencias entre especies en la anatomía cortical que pueden estar relacionadas con la plasticidad. Estos estudios han mostrado algunas similitudes en los patrones de desarrollo postnatal de la distribución neuronal y la morfología dendrítica en áreas prefrontales de chimpancés y humanos. El estudio de los patrones de sinaptogénesis en chimpancés en desarrollo también ha mostrado que, de forma similar a los humanos, la densidad de sinapsis en chimpancés alcanza el punto máximo durante el periodo juvenil, seguido de un periodo posterior de poda sináptica dependiente del entorno que conduce a la formación de circuitos neuronales y comportamientos adultos (Bianchi et al., 2013). Sin embargo, se ha demostrado que la mielinización neocortical se alarga más en el desarrollo de los humanos que en los chimpancés. Estos llegan a niveles de mielinización adultos cuando alcanzan la madurez sexual, mientras que la mielinización se alarga en humanos hasta la adolescencia tardía (Miller et al., 2012). Esa maduración prolongada en los humanos podría ser producto de los cambios del desarrollo que ocurren en etapas anteriores de la vida, o de una adaptación concreta relacionada con una mayor refinación en las funciones cognitivas y ejecutivas que caracterizan la transición de la adolescencia al comienzo de la edad adulta en humanos (Miller et al., 2012). Cambios fundamentales en la toma de decisiones y la regulación de emociones ocurren durante esta etapa en la vida de los humanos, pero no hay datos comparables para determinar si otros primates sufren cambios similares en el desarrollo de la cognición durante el periodo final de desarrollo pre-adulto.

Los análisis de grandes muestras de resonancias magnéticas de cerebros humanos y de chimpancés han demostrado que la organización cortical no tiene una fuerte determinación genética en humanos, como sí ocurre en chimpancés. Esta diferencia apunta a un mayor nivel de influencia del entorno en la organización cortical en humanos (Gómez-Robles, Hopkins, Schapiro y Sherwood, 2015). Esta débil heredabilidad genética en humanos es especialmente marcada en las áreas de asociación, que también muestran la mayor expansión desde el nacimiento hasta la edad adulta y durante la evolución de los primates (Hill et al., 2010). Curiosamente, algunos estudios han encontrado una correlación entre los cambios en estas mismas áreas y los resultados de algunos tests cognitivos que reflejan la función intelectual (Fjell et al., 2015).
El estudio de pequeñas muestras longitudinales de resonancias magnéticas de chimpancés ha proporcionado información adicional relevante para estudiar la plasticidad del desarrollo (Sakai et al., 2012). Los incrementos en el volumen cerebral muestran un curso prolongado tanto en chimpancés como en humanos, pero solo los humanos se caracterizan por un incremento mucho más rápido en el volumen de materia blanca en la infancia temprana (Sakai et al., 2012). Esto sugiere que los cambios dinámicos del desarrollo observados en el tejido cerebral humano, que están relacionados con la creación de conexiones neuronales, podrían haber surgido tras la separación entre chimpancés y humanos de su antepasado común.
El registro fósil y la evolución de la plasticidad del cerebro humano
El estudio de la evolución de la plasticidad del cerebro en homininos es un gran reto debido a la naturaleza fragmentaria del registro fósil y al hecho de que los tejidos blandos no se preservan. En consecuencia, la paleoantropología ha estudiado esta cuestión mediante análisis de la evolución del desarrollo inferido a partir de los cambios en el volumen endocraneal y otros indicadores de crecimiento. Generalmente se asume que el cambio hacia un patrón de desarrollo más altricial observado en la evolución de los homininos está relacionado con un aumento en el nivel de plasticidad cerebral debido al crecimiento y maduración del cerebro a lo largo de un periodo más largo de tiempo (Hublin, Neubauer y Gunz, 2015). Sin embargo, la plasticidad no se ha estudiado directamente en moldes endocraneales de homininos. El estudio de los patrones de desarrollo en homininos se enfrenta a importantes retos, en particular a la falta de acuerdo respecto a cuándo surgió el patrón altricial humano moderno. Además, los procesos de crecimiento, su duración y ritmo, son tremendamente difíciles de analizar en muestras que no son representativas de todo el periodo de desarrollo. Existen muy pocos restos endocraneales de infantes y jóvenes homininos.

Figura 2. Las crías de primates no humanos nacen con una movilidad relativamente avanzada. Su ritmo de desarrollo se considera precoz en comparación con otros mamíferos y con humanos. Arriba, un grupo de chimpancés y, a la izquierda, una cría. / Foto: Steve Hams, OL
Distintos autores han sugerido dos clases principales de limitaciones para explicar la evolución inicial de la altricialidad humana: limitaciones obstétricas (Rosenberg, 1992) o metabólicas (Dunsworth, Warrener, Deacon, Ellison y Pontzer, 2012). Ambos tipos de restricciones están relacionadas con la evolución de un cerebro progresivamente más grande que, en combinación con el canal del parto reducido típico de los homininos bípedos, plantea limitaciones espaciales durante el parto (Rosenberg, 1992), o que requiere grandes cantidades de energía que la madre no puede proporcionar, truncando así la gestación (Dunsworth et al., 2012). En ambos modelos, la evolución de un patrón de desarrollo altricial está relacionada con el aumento del tamaño del cerebro en los homininos. En consecuencia, es probable que los australopitecos y otros homininos tempranos con cerebros relativamente pequeños y configuraciones corporales diferentes a las modernas mostrasen un patrón de desarrollo más precoz, similar al que caracteriza a las especies vivas de grandes simios.
«El ritmo de desarrollo de los primates se considera relativamente precoz: las crías nacen después de un largo período de gestación con unas conductas y una mobilidad relativamente avanzadas y maduras»
Se podría inferir que especies de homininos con un tamaño cerebral comparable al de los humanos modernos, como los neandertales y, posiblemente, el último antepasado común de los neandertales y los humanos modernos, habrían mostrado un patrón altricial de desarrollo y crecimiento cerebral. Sin embargo, algunos autores han observado que el patrón de desarrollo postnatal temprano difiere sustancialmente entre neandertales y humanos modernos; estos últimos muestran una fase durante la que el endocráneo adquiere una forma globular que no se observa en los primeros (Gunz, Neubauer, Maureille y Hublin, 2010). Ciertos factores funcionales relacionados con la reorganización del lóbulo parietal superior en los humanos modernos podrían estar detrás de estas diferencias (Bruner, De la Cuétara y Holloway, 2011; Gunz et al., 2010), pero se ha sugerido también que la adquisición de esta forma globular puede ser el resultado de interacciones genéticas generalizadas entre diferentes elementos del complejo craneofacial (Martínez-Abadías et al., 2012).
La determinación del patrón de desarrollo de especies con un tamaño cerebral intermedio entre el de los humanos modernos y el de los grandes simios, como Homo erectus, es más complicada. Mientras que algunos investigadores han estimado que el patrón de desarrollo cerebral postnatal de Homo erectus estaba en un punto intermedio entre el de los chimpancés y el de los humanos modernos, otros sugieren que su patrón de desarrollo estaba dentro del rango de variación de Homo sapiens (revisado en Hublin et al., 2015). Es difícil elegir entre una de estas dos hipótesis porque las dos se enfrentan a inconvenientes similares. En primer lugar, la mayoría de inferencias en relación con los patrones de desarrollo de Homo erectus se basan en el estudio de un solo espécimen, el niño de Mojokerto. Como el ritmo de crecimiento del cerebro se estima en base a la proporción del tamaño cerebral adulto que había alcanzado este niño en el momento de su muerte, las inferencias dependen críticamente de su edad, que se calcula entre uno y ocho años. En segundo lugar, los patrones de desarrollo a menudo se estiman a partir de comparaciones entre el tamaño endocraneal infantil y adulto, lo que ofrece una estimación demasiado general del ritmo y la duración del crecimiento cerebral y no puede ofrecer información sobre los mecanismos celulares y moleculares de desarrollo, incluyendo los procesos de crecimiento axonal y dendrítico, la sinaptogénesis y la poda sináptica y neuronal que subyace al establecimiento de los circuitos neuronales, la mielinización o el repliegue del neocórtex. En tercer lugar, otra fuente de discrepancia corresponde a la edad geológica del niño de Mojokerto, que se estima entre 1,2 y 1,8 millones de años. Aunque esta variación es notable de por sí y tiene consecuencias importantes para las inferencias sobre el desarrollo, ciertamente corresponde a un representante temprano de Homo erectus, cuyo rango temporal se estima entre hace 1,8 millones de años y menos de 100.000 años. Para complicar aún más este escenario, existe una tendencia hacia el incremento del tamaño del cerebro entre los primeros y los últimos Homo erectus, por lo que no se puede descartar una modificación gradual en los patrones de desarrollo durante su evolución.
«Diversos estudios comparativos han descrito diferencias entre especies en la anatomía cortical que pueden estar relacionadas con la plasticidad »
Los cambios en el desarrollo tardío también pueden tener un efecto en la plasticidad cerebral. El periodo extendido de desarrollo cerebral observado en Homo sapiens ofrece una oportunidad adicional para la maduración cerebral dependiente del entorno durante la adolescencia y el comienzo de la edad adulta, durante el cual ocurren procesos importantes como la mielinización (Miller et al., 2012) y la poda continuada de las espinas sinápticas en el córtex prefrontal (Petanjek et al., 2011). Es de esperar que este periodo de maduración cerebral prolongado cumpla un papel menos crítico que el periodo postnatal inicial en el aumento de la plasticidad cerebral, ya que durante el periodo inicial es cuando tienen lugar los procesos más importantes de crecimiento cerebral y establecimiento de dominios corticales. No obstante, se ha sugerido que el periodo de adolescencia es importante en la adquisición de habilidades sociales y en el establecimiento de formas adultas de lenguaje y comunicación, así como en la adquisición de habilidades adultas relacionadas con la búsqueda de alimento (Schuppli et al., 2012).
Los estudios sobre la historia vital de las especies de homininos se basan en su mayoría en inferencias a partir del desarrollo dental. Además de ser muy abundantes y estar muy bien conservados en el registro fósil, los dientes son menos sensibles que otros tejidos a las perturbaciones relacionadas con el desarrollo y a perturbaciones ecológicas a corto plazo; por esto son útiles para inferir patrones de maduración a partir de la microestructura dental, su secuencia temporal y de erupción. Estos estudios dentales han mostrado que algunos aspectos del patrón de desarrollo típico de nuestra especie podrían haber surgido hace cerca de un millón de años (Bermúdez de Castro et al., 2010), pero otros estudios han mostrado diferencias sutiles en los patrones de desarrollo entre los neandertales y los humanos modernos (Smith et al., 2010) que podrían estar relacionadas con diferencias en la plasticidad cerebral.
Inferencias a partir del ADN antiguo
La información acerca de la evolución de la plasticidad cerebral también se puede adquirir mediante el estudio de ADN antiguo, comparando el genoma de humanos modernos, neandertales y denisovanos. Aunque recientemente se ha obtenido ADN mitocondrial y nuclear de algunos homininos del Pleistoceno medio, la información paleogenómica sobre estos homininos todavía es demasiado limitada como para incluirla en esta comparación. Entre los genes que muestran cambios específicos de los humanos, varios tienen que ver con el crecimiento y el desarrollo cerebral. En particular, diversos estudios han demostrado que la versión humana de FOXP2, un gen cuya mutación está relacionada con trastornos graves del habla, aumenta la plasticidad en los circuitos del córtex y el cuerpo estriado cuando se expresa en ratones (Enard et al., 2009). La versión humana de este gen, que difiere de la del chimpancé, también se ha encontrado en neandertales y denisovanos, lo que indica que las tres especies pueden haber compartido las formas de plasticidad cerebral asociadas con la versión humana de FOXP2 (figura 4). Sin embargo, otros estudios han sugerido que, aunque algunos cambios en la secuencia de FOXP2 podrían haber evolucionado antes de la divergencia de neandertales, denisovanos y humanos modernos, ciertos cambios en la regulación de este gen podrían ser únicos de los humanos modernos (Maricic et al., 2013).
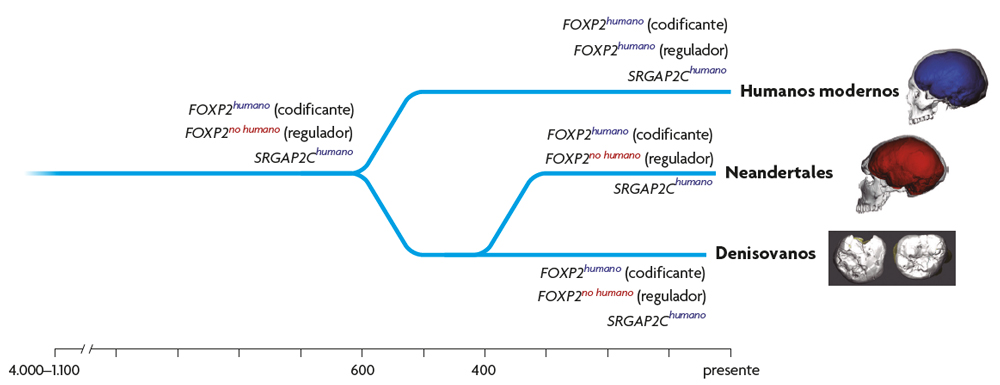
Figura 4. Evolución de genes relacionados con la plasticidad inferidos a partir de ADN antiguo. Los cambios en la secuencia de FOXP2 típicos de los humanos modernos también se encuentran en los neandertales y los denisovanos, mientras que los cambios en su regulación parecen ser únicos de los humanos modernos. Las tres especies comparten los cambios en la evolución de formas parálogas de SRGAP2.
SRGAP2, un gen implicado en el desarrollo neocortical, también puede haber sido importante en la evolución de la plasticidad del cerebro humano. Este gen ha sufrido dos duplicaciones después de la divergencia entre chimpancés y humanos. Una de estas duplicaciones, designada SRGAP2C, se expresa en el cerebro humano en desarrollo, donde dimeriza con la forma ancestral SRGAP2, inhibiendo su función. Esta inhibición subyace a ciertos cambios de desarrollo neuronal específicos de los humanos que están relacionados con la plasticidad cerebral, incluyendo la neotenia durante la maduración de las espinas sinápticas. Esta duplicación probablemente ocurrió hace entre dos y tres millones de años (Dennis et al., 2012), coincidiendo aproximadamente con la aparición del género Homo, en el que se observa una expansión neocortical continuada y una intensificación de la manufactura generalizada de herramientas. De acuerdo con esta estimación, los mismos investigadores han demostrado que tanto los neandertales como los denisovanos presentaban las mismas duplicaciones que los humanos (Dennis et al., 2012). Como en el caso de la evolución de FOXP2, distintas especies del género Homo parecen haber compartido aspectos específicos de la plasticidad cerebral relacionados con la evolución de las formas parálogas de SRGAP2 (figura 4).
«Los cambios dinámicos del desarrollo observados en el tejido cerebral humano podrían haber surgido después de la separación entre chimpancés y humanos de su antepasado común»
La regulación epigenética está influida por diversos factores, incluyendo efectos estocásticos, genéticos y ambientales. Por lo tanto, el estudio del epigenoma es una nueva y prometedora herramienta para evaluar la evolución de la plasticidad cerebral. La metilación de la citosina es uno de los marcadores epigenéticos más conocidos, y frecuentemente se asocia con el silenciamiento genético. Estudios recientes han utilizado el proceso natural de degradación de citosinas metiladas y no metiladas para inferir los mapas de metilación en denisovanos y neandertales (Gokhman et al., 2014), para los cuales existe información detallada de su genoma. La comparación de los epigenomas de neandertales, denisovanos y humanos modernos ha mostrado regiones con diferentes niveles de metilación que son especialmente comunes en genes relacionados con el cerebro (Gokhman et al., 2014).
En principio podría parecer que esta observación respalda la conclusión de que hay diferencias en la plasticidad cerebral entre estas especies. Sin embargo, estos resultados son difíciles de interpretar considerando las dificultades intrínsecas de estudiar la variación epigenética en un contexto paleoantropológico. Los patrones de metilación del ADN son específicos para el tipo de célula y la etapa de desarrollo. Como los mapas de metilación en neandertales y denisovanos se han obtenido a partir de tejido óseo, es difícil saber cómo se puede extrapolar la huella epigenética observada al tejido cerebral en desarrollo. Los mapas de metilación en neandertales y denisovanos pueden representar huellas epigenéticas individuales y específicas de los huesos, pero su utilidad para arrojar luz sobre la complejidad de los cambios epigenéticos durante el desarrollo de diferentes órganos es limitada.
Observaciones finals
Cada vez hay más pruebas de que una de las especializaciones clave del cerebro humano es su alto grado de plasticidad. Los estudios comparativos con grandes simios muestran que los cerebros humanos son sustancialmente más plásticos que los de nuestros parientes vivos más próximos. Los análisis paleontológicos y paleogenéticos, no obstante, muestran que otras especies fósiles de nuestro árbol evolutivo, como los neandertales y los denisovanos, pueden haber compartido ciertos aspectos de esta plasticidad cerebral con los humanos modernos.
«Cada vez hay más pruebas que una de las especializaciones clave del cerebro humanos es su alto grado de plasticidad. Los cerebros humanos son substancialmente más plásticos que los de nuestros parientes vivos más»
Un alto nivel de plasticidad puede ser el resultado indirecto de la selección por los partos tempranos en especies de homininos con un tamaño cerebral mayor, lo cual supone límites obstétricos y metabólicos que se pueden relajar dando a luz a crías inmaduras cuyo cerebro se desarrollará después del nacimiento y bajo la influencia de numerosas influencias ambientales, sociales y culturales. Diferentes estudios han mostrado que estas influencias pueden modelar la anatomía cerebral y el comportamiento. Un cerebro plástico puede usar de forma más eficiente la experiencia externa para formar los circuitos neuronales que son responsables del comportamiento, por lo que la plasticidad cerebral puede servir como enlace entre la evolución biológica y la evolución cultural.
Referencias
Bermúdez de Castro, J. M., Martinón-Torres, M., Prado, L., Gómez-Robles, A., Rosell, J., López-Polín, L., … Carbonell, J. L. (2010). New immature hominin fossil from European Lower Pleistocene shows the earliest evidence of a modern human dental development pattern. Proceedings of the National Academy of Sciences, 107(26), 11739–11744. doi: 10.1073/pnas.1006772107
Bianchi, S., Stimpson, C. D., Duka, T., Larsen, M. D., Janssen, W. G. M., Collins, Z., … Sherwood, C. C. (2013). Synaptogenesis and development of pyramidal neuron dendritic morphology in the chimpanzee neocortex resembles humans. Proceedings of the National Academy of Sciences, 110(2), 10395–103401. doi: 10.1073/pnas.1301224110
Bruner, E., De La Cuétara, J. M., & Holloway, R. L. (2011). A bivariate approach to the variation of the parietal curvature in the genus Homo. The Anatomical Record, 294(9), 1548–1556. doi: 10.1002/ar.21450
Dennis, M.Y., Nuttle, X., Sudmant, P. H., Antonacci, F., Graves, T. A., Nefedov, M., … Eichler, E. E. (2012). Evolution of human-specific neural SRGAP2 genes by incomplete segmental duplication. Cell, 149(4), 912–922. doi: 10.1016/j.cell.2012.03.033
Dunsworth, H. M., Warrener, A. G., Deacon, T., Ellison, P. T., & Pontzer, H. (2012). Metabolic hypothesis for human altriciality. Proceedings of the National Academy of Sciences, 109(38), 15212–15216. doi: 10.1073/pnas.1205282109
Enard, W., Gehre, S., Hammerschmidt, K., Hölter, S. M., Blass, T., Somel. M., … Pääbo, S. (2009). A humanized version of FOXP2 affects cortico-basal ganglia circuits in mice. Cell, 137(5): 961–971. doi: 10.1016/j.cell.2009.03.041
Fjell, A. M., Westlye, L. T., Amlien, I., Tamnes, C. K., Grydeland, H., Engvig, A., … Walhovd, K. B. (2015). High-expanding cortical regions in human development and evolution are related to higher intellectual abilities. Cerebral Cortex, 25(1), 26–34. doi: 10.1093/cercor/bht201
Gokhman, D., Lavi, W., Prüfer, K., Fraga, M. F., Riancho, J. A., Kelso, J., … Carmel, L. (2014). Reconstructing the DNA methylation maps of the Neandertal and the Denisovan. Science, 344(6183), 523–527. doi: 10.1126/science.1250368
Gómez-Robles, A., Hopkins, W. D., Schapiro, S. J., & Sherwood, C. C. (2015). Relaxed genetic control of cortical organization in human brains compared with chimpanzees. Proceedings of the National Academy of Sciences, 112(51), 14799–14804. doi: 10.1073/pnas.1512646112
Gunz, P., Neubauer, S., Maureille, B., & Hublin, J. J. (2010). Brain development after birth differs between Neanderthals and Modern Humans. Current Biology, 20(21), R921–R922. doi: 10.1016/j.cub/.2010.10.018
Hill, J., Inder, T., Neil, J., Dierker, D., Harwell, J., & Van Essen, D. (2010). Similar patterns of cortical expansion during human development and evolution. Proceedings of the National Academy of Sciences, 107(29), 13135–13140. doi: 10.1073/pnas.1001229107
Hublin, J. J., Neubauer, S., & Gunz, P. (2015). Brain ontogeny and life history in pleistocene hominins. Philosophical Transactions of the Royal Society B, 370(1663), 20140062. doi: 10.1098/rsrb.2014.0062
Maricic, T., Günther, V., Georgiev, O., Gehre, S., Curlin, M., Schreiweis, C., … Pääbo, S. (2013). A recent evolutionary change affects a regulatory element in the human FOXP2 gene. Molecular Biology and Evolution, 30(4), 844–852. doi: 10.1093/molbev/mss271
Martínez-Abadías, N., Esparza, E., Sjøvold, T., González-José, R., Santos, M., Hernández, M., & Klingenberg, C. P. (2012). Pervasive genetic integration directs the evolution of human skull shape. Evolution, 66(4), 1010–1023. doi: 10.1111/j.1558-5646.2011.01496.x
Miller, D. J., Duka, T., Stimpson, C. D., Schapiro, S. J., Baze. W. B., McArthur, M. J., … Sherwood, C. C. (2012). Prolonged myelination in human neocortical evolution. Proceedings of the National Academy of Sciences, 109(41), 16480–16485. doi: 10.1073/pnas.1117943109
Petanjek, Z., Judaš, M., Šimić, G., Rašin, M. R., Uylings, H. B. M., Rakic, P., & Kostović, I. (2011). Extraordinary neoteny of synaptic spines in the human prefrontal cortex. Proceedings of the National Academy of Sciences, 108(32), 13281–13286. doi: 10.1073/pnas.1105108108
Portmann, A. (1969). Biologische Fragmente Zu Einer Lehre Vom Menschen. Basel: Benno Schwabe.
Rosenberg, K. R. (1992). The evolution of modern human childbirth. American Journal of Physical Anthropology, 35(S15), 89–124. doi: 10.1002/ajpa.1330350605
Sacher, G. A., & Staffeldt, E. F. (1974). Relation of gestation time to brain weight for placental mammals: Implications for the theory of vertebrate growth. American Naturalist, 108(963), 593–615.
Sakai, T., Matsui, M., Mikami, A., Malkova, L., Hamada, Y., Tomonaga, M., … Matsuzawa, T. (2012). Developmental patterns of chimpanzee cerebral tissues provide important clues for understanding the remarkable enlargement of the human brain. Proceedings of the Royal Society B, 280(1753), 20122398. doi: 10.1098/rspb.2012.2398
Schuppli, C., Isler, K., & Van Schaik, C. P. (2012). How to explain the unusually late age at skill competence among humans. Journal of Human Evolution, 63(6), 843–850. doi: 10.1016/j.jhevol.2012.08.009
Smith, T. M., Tafforeau, P., Reid, D. J., Pouech, J., Lazzari, V., & Zermeno, J. P. (2010). Dental evidence for ontogenetic differences between modern humans and Neanderthals. Proceedings of the National Academy of Sciences, 107(49), 20923–20928. doi: 10.1073/pnas.1010906107
Tau, G. Z., & Peterson, B. S. (2009). Normal development of brain circuits. Neuropsychopharmacology, 35(1), 147–168. doi: 10.1038/npp.2009.115





