¿Una progenie espantosa?
El futuro del cultivo de humanos

Las biotecnologías actuales no solo ofrecen nuevas posibilidades para la medicina, también están transformando lo que entendemos por ser humano. Concretamente, el descubrimiento de la extrema plasticidad de las células –la posibilidad de intercambiar tipos de tejidos y de regenerar el estado celular embrionario a partir del cual crecemos– nos obliga a enfrentarnos al hecho de que somos una comunidad contingente de células vivas, y desafía las ideas tradicionales de autoconsciencia e identidad. En este artículo se exploran algunas de estas tecnologías y sus implicaciones sociales, éticas y filosóficas.
Palabras clave: ingeniería de tejidos, células madre, organoides, reprogramación celular, transhumanismo.
La idea de ensamblar un cuerpo humano adulto a partir de componentes, presente en novelas como Frankenstein (1818) de Mary Shelley o la obra teatral R. U. R. (1921) de Karel Čapek (que introdujo el término robot), sigue enmarcada en la antigua visión cartesiana del cuerpo como mecanismo. Pero si ha de existir un futuro para seres «artificiales» hechos de carne y hueso, estos serán cultivados en lugar de construidos, emulando al menos parte del proceso por el cual un grupo de células madre se convierte en un feto en el útero. A medida que mejora nuestra comprensión de las técnicas de manipulación de células vivas, podemos imaginar la creación de seres humanos a partir de agregados artificiales de células y tejidos.
Sin embargo, ¿en qué punto podemos considerar que una intervención sobre el proceso de desarrollo humano lo hace artificial? Incluso antes de la fecundación in vitro (FIV), ya se hablaba de inseminación artificial, mientras que el propio proceso de FIV se enmarcó insistentemente como un proceso tecnológico a través de la idea de bebés probeta (aunque las probetas, símbolo de la síntesis química, no tenían nada que ver con el proceso). Algunas intervenciones «artificiales» actuales que han despertado polémica son la detección y selección de embriones, la edición genética y los supuestos bebés con «tres padres» resultantes de la transferencia mitocondrial. En cierto modo, las tecnologías reproductivas potenciales descritas en este artículo solo son el siguiente paso; bien podría ser que las personas que empiecen su desarrollo con una de estas técnicas sean en el futuro consideradas tan «normales» como lo son hoy en día las personas concebidas por FIV. Y tal vez todo ello sea positivo, pero esto no resta urgencia a los debates éticos y sociales relacionados con estas tecnologías.
Reprogramación celular
En 2006, el biólogo japonés Shinya Yamanaka y su equipo de la Universidad de Kyoto descubrieron que se pueden revertir células maduras y diferenciadas (como una célula de la piel adulta) a un estado similar al de las células madre añadiendo solo cuatro genes muy expresados en las células madre embrionarias, por ejemplo, utilizando un virus como vector portador de genes. Estos experimentos se realizaron primero con células de ratones (Takahashi y Yamanaka, 2006) y después con células humanas (Takahashi et al., 2007). A estas células reprogramadas se las conoce como células madre pluripotentes inducidas (iPSC, por sus siglas en inglés); en principio, pueden ser cultivadas en cualquier tipo de tejido guiando su desarrollo posterior. El descubrimiento no solo tenía potencial como herramienta para la ingeniería de tejidos, sino que también corrigió lo que pensábamos hasta entonces al mostrar que el «destino» de las células no está fijado, y que el proceso de diferenciación no es una vía de sentido único. Las células son mucho más plásticas y versátiles de lo que se creía. Ahora sabemos que una célula madura también se puede transformar directamente en otro tipo de célula por medios similares, sin necesidad de revertirla al estado de célula madre.
«¿En qué punto podemos considerar que una intervención sobre el proceso de desarrollo humano lo hace artificial?»
Cuando se cultivan in vitro, estas células reprogramadas pueden organizarse en versiones aproximadas de las respectivas estructuras y tejidos que formarían en un embrión. Las células renales pueden formar pequeñas estructuras similares a un riñón; las células intestinales forman tejidos ciliados en forma de tubo digestivo; y las neuronas adoptan algunas de las formas del cerebro, como las capas de una pseudocorteza o las yemas del tubo neural (Kim et al., 2020). Estas estructuras pueden servir como sistemas modelo para la investigación del desarrollo y como sustrato para probar medicamentos. Se espera que también funcionen como piezas de repuesto que se puedan utilizar como injertos. Si estos injertos se cultivan a partir de iPSC del receptor, se evitarían los problemas de rechazo inmunológico que afectan a los trasplantes de órganos actuales.

También es posible cultivar estas estructuras «organoides» a partir de células madre embrionarias normales (ESC, por sus siglas en inglés) tomadas de embriones FIV descartados. Tanto las iPSC como las ESC son técnicas modernas esenciales para el cultivo y la transformación celular. Ya han demostrado ser prometedoras para, por ejemplo, reparar una médula dañada (Nagoshi et al., 2019), revertir el deterioro de la visión (Li et al., 2017) y la audición (Tang et al., 2020) y restaurar las neuronas cerebrales perdidas por culpa de enfermedades degenerativas (Payne et al., 2015).
Pero las posibilidades van mucho más allá de la medicina regenerativa. Estos métodos pueden proporcionar nuevas posibilidades para el desarrollo de seres humanos. En 2009, Kristin Baldwin y su equipo del Centro de Investigación Scripps en California consiguieron crear ratones adultos a partir de células de la piel (fibroblastos) de otros ratones (Boland et al., 2009). Reprogramaron las células utilizando los factores de Yamanaka e inyectaron estas iPSC en un embrión blastocisto de ratón (un estado temprano del embrión en que empieza a aparecer su estructura), que previamente habían manipulado para evitar que sus células se siguieran desarrollando. Por lo tanto, cada feto de ratón desarrollado a partir de este blastocisto se derivaba únicamente de las iPSC. Cada uno de los fetos creció hasta convertirse en cría y nació por cesárea; alrededor de la mitad sobrevivieron y siguieron creciendo hasta la edad adulta sin ninguna anormalidad aparente. En otras palabras, al menos algunas iPSC tienen la capacidad de convertirse en organismos completamente nuevos. No existen razones obvias por las que este enfoque no funcione en células humanas, aunque en este momento un experimento así –con riesgos desconocidos para la salud– sería extremadamente poco ético y, en algunos países, ilegal.
Los embriones construidos artificialmente (Simunovic y Brivanlou, 2017) suelen crearse a partir de ESC, en lugar de iPSC. Aunque las ESC extraídas de la masa celular interna del blastocisto pueden, en principio, convertirse en cualquier tipo de tejido en el cuerpo, no pueden desarrollarse como embrión completo por sí mismas, porque han perdido su capacidad para desarrollar la placenta y el saco vitelino; esto es lo que distingue su «pluripotencia» de la «totipotencia» de las células embrionarias preblastocisto.
No obstante, se sabe desde hace más de una década que las ESC no pueden, por sí solas, convertirse en una agrupación embrionaria. En un medio de cultivo, se diferenciarán pequeños grupos para formar la estructura de tres capas que precede a la gastrulación: el ectodermo (que forma la piel), el mesodermo (sangre, corazón, riñones, músculo y otros tejidos) y el endodermo (aparato digestivo interno). Sin embargo, el proceso suele acabar ahí, con estos «cuerpos embrioides» que son solo bolas de células con capas concéntricas. En un embrión humano de desarrollo normal, esta triple capa de tipos de célula comienza a plegarse y toma la forma de la gástrula: la primera aparición de un verdadero plan corporal. Pero para que esto suceda, es necesario implantar el embrión en la pared del útero, un proceso que se puede imitar toscamente utilizando un biopolímero (colágeno, por ejemplo) como sustituto del útero. Se podría llegar más lejos en el proceso de desarrollo añadiendo los otros tejidos que necesitan los embriones. La receta más simple implica solo dos tipos de célula: ESC pluripotentes y las células que dan lugar a la placenta, conocidas como trofoblasto. Estas últimas células envían señales a las ESC en el útero y las induce a tomar la forma de un embrión gastrulado.
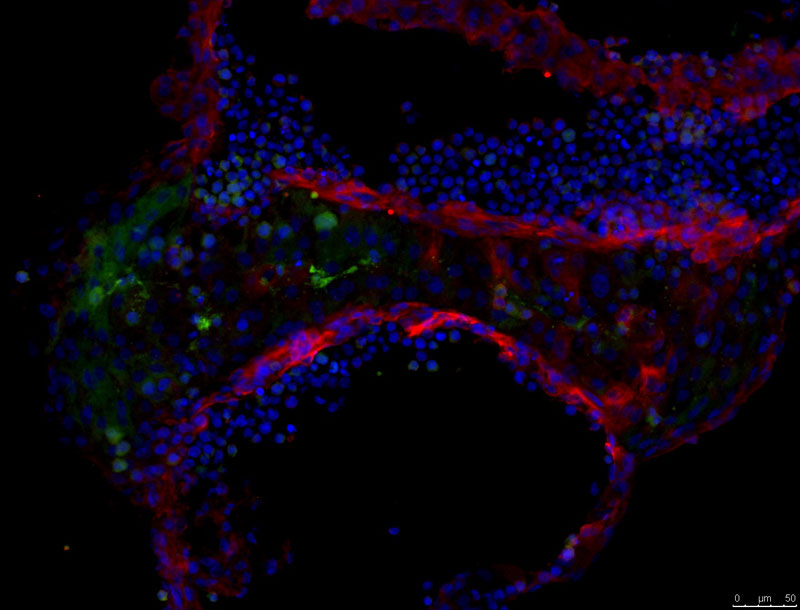
En 2017, Magdalena Zernicka-Goetz y sus compañeros de la Universidad de Cambridge utilizaron esta receta para crear una forma más avanzada de embrioide de ratón (Harrison et al., 2017). A esta mezcla de dos componentes todavía le falta otro tipo de célula extraembrionaria presente en un embrión normal, las células endodérmicas primitivas. Estas células forman el saco vitelino del embrión en el útero y aportan las moléculas señalizadoras necesarias para desencadenar la formación del sistema nervioso central. En este experimento, el gel utilizado como medio de cultivo podía actuar como un sustituto aproximado del endodermo primitivo: un sustrato que mantendría en su sitio al embrioide mientras los trofoblastos hacen su trabajo. Esta estructura compuesta desarrolló la forma hueca de un embrión de ratón gastrulado, en la que el vacío del centro imita la cavidad amniótica que se forma en un embrión normal. En este punto, el embrioide ya era un «gastruloide».
Muchos de los procesos básicos en la embriogénesis temprana de los ratones son iguales que en los humanos, pero el desarrollo se hace muy diferente en la etapa de gastrulación: la gástrula de un ratón no se parece mucho a la de un humano. Sin embargo, no es tan evidente que haya obstáculos fundamentales para crear embrioides humanos de al menos este nivel de complejidad. Los trofoblastos humanos –el ingrediente esencial para lograr una señal como la de la placenta– se pueden crear ahora a partir de las células madre (Kojima et al., 2017). Es más, se han desarrollado trofoblastos humanos como organoides que imitan a la placenta, hecho que acerca la posibilidad de un tejido in vitro que nutra a los embrioides en sustitución del entorno materno. El biólogo de células madre Martin Pera, del Laboratorio Jackson en Maine (EE. UU.), dice que «no hay razón para pensar que exista ninguna barrera infranqueable para la creación de cultivos celulares in vitro que se asemejen al embrión humano tras la implantación» (Pera, 2017, p. 138).
Nuevos tipos de vida
Tal vez las barreras no sean técnicas, sino conceptuales. Debemos preguntarnos: ¿qué clase de ser vivo es esta entidad? Los embrioides y los gastruloides no son exactamente versiones sintéticas de las estructuras equivalentes de la embriogénesis habitual, y ninguno de ellos tiene el más mínimo potencial para continuar su desarrollo in vitro hasta convertirse en una cría animal. Son un tipo distinto de seres vivos. Anticipándose a la evolución futura de las rudimentarias estructuras embrioides actuales creadas con células humanas hacia formas más complejas como las creadas a partir de células de ratones, George Church, de la Universidad de Harvard, ha propuesto llamar a esta familia de objetos vivos presentes y futuros como entidades humanas sintéticas con características embrionarias (SHEEF, por sus siglas en inglés) (Aach et al., 2017).
La mayoría de los investigadores recomiendan prohibir el uso de entidades con características embrionarias creadas a partir de células madre con fines reproductivos. Pero incluso aunque no fuera para «crear un humano», la investigación con embriones humanos ordinarios está mucho más limitada; muchos países imponen un límite de catorce días al crecimiento in vitro de los embriones. Esta es la etapa en la que los embriones humanos normales desarrollan la «línea primitiva» que finalmente se convertirá en el sistema nervioso central: una aproximación de lo que constituye una «persona». Pero es posible que los embrioides y las SHEEF no sigan este desarrollo natural en absoluto. Y si no es así, ¿cómo podemos decidir cuál debe ser el límite para su desarrollo?
En parte por esta razón, no existe consenso sobre cómo legislar sobre la investigación con embrioides y SHEEF. No solo porque su validez ética sea ambigua; no existe una forma estándar de embrioide. Son como queramos crearlos, y las células trabajan con lo que se les proporciona.
Reescribir las reglas
Editar genomas es posible desde los años setenta del siglo XX: podemos extirpar o insertar genes a voluntad, en ocasiones de especies completamente diferentes. Una técnica llamada CRISPR, desarrollada en 2012 principalmente por los bioquímicos Emmanuelle Charpentier, Jennifer Doudna y Feng Zhang, ha transformado esta disciplina por la precisión con la que permite seleccionar y editar el genoma (Adli, 2018). CRISPR utiliza las proteínas Cas, una familia de enzimas bacterianas naturales que parten el ADN (normalmente llamadas Cas9, aunque otras también tienen usos especializados), para seleccionar y editar genes. Una molécula de «ARN guía» transportada junto a la Cas9 reconoce la sección elegida del ADN.
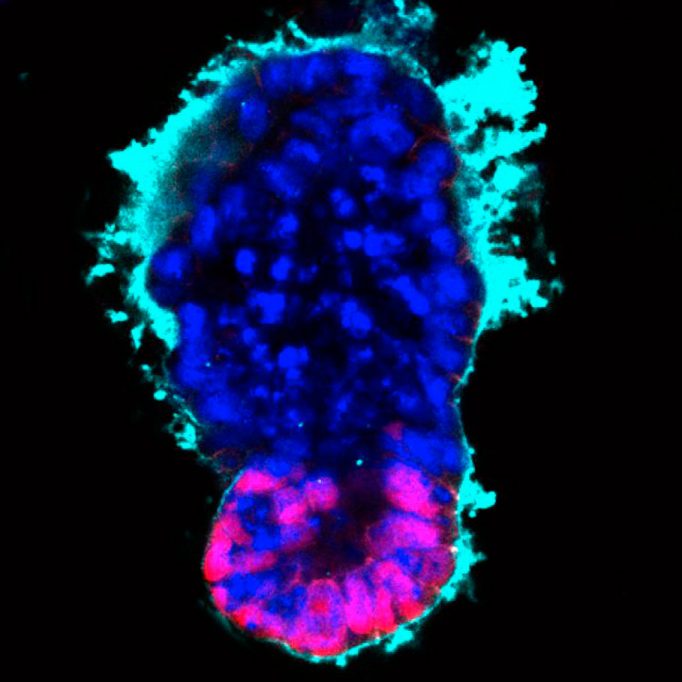
Gástrula sintética o gastruloide creada por Madgalena Zernicka-Goetz y sus colaboradores mediante el ensamblaje de células madre embrionarias (en magenta) y trofoblastos preplacentarios (azul) dentro de una «matriz extracelular» sintética (cian) que imita las células que faltan del endodermo primitivo, el tercer componente crítico de un verdadero embrión en fase de gastrulación./ Cortesía de Magdalena Zernicka-Goertz y Marta Shahbazi, Universidad de Cambridge
CRISPR es más precisa y económica que otras técnicas de edición genética anteriores. Potencialmente, este método podría ser una potente herramienta para curar enfermedades provocadas por mutaciones en un gen específico (o unos pocos genes), como la distrofia muscular y la talasemia. Los ensayos clínicos en humanos para estos tratamientos ya están en marcha.
Estas terapias genéticas candidatas tratan de alterar los genes en las células somáticas. Sin embargo, cualquier cambio realizado en un gen en un embrión temprano se incorpora a la línea germinal y se transmitirá a las generaciones futuras. Por esa razón, los científicos dudan de la conveniencia de introducir cambios en la línea germinal. Es más, si el proceso de edición provoca cualquier otra alteración en el genoma en esta etapa temprana de desarrollo, dichos cambios se extenderán por todo el organismo a medida que crezca el embrión.
Ya se ha utilizado CRISPR para modificar genéticamente embriones humanos, con el objetivo de ver si es, en principio, posible. Pero su uso para la reproducción humana está prohibido en todos los países que han legislado al respecto, y la comunidad de investigación médica casi por completo lo rechazan de pleno. Por ello, quedó sorprendida y consternada cuando, a finales de 2018, el biólogo chino He Jiankui anunció que había utilizado este método para modificar varios embriones FIV e implantarlos en mujeres, una de las cuales había dado a luz a gemelas. Utilizó CRISPR para alterar un gen llamado CCR5, relacionado con la infección de células con el virus del VIH, para obstaculizar la entrada del virus en las células –esta intervención entra en conflicto con la idea general de que no se debería utilizar la edición genética a menos que responda a una necesidad médica–. Para empeorar las cosas, al parecer el trabajo fue bastante chapucero y se produjeron modificaciones del genoma diferentes a las deseadas.
«Los genes no funcionan como sería necesario para permitir la producción fiable y predictiva de “bebés de diseño”»
Aun así, no existen razones obvias que nos hagan descartar para siempre la edición del genoma para la reproducción humana (Greely, 2021). En aquellos casos relativamente raros en los que una enfermedad debilitante está causada por un único gen y las consecuencias de reemplazar la versión defectuosa por una sana se pueden predecir de forma fiable, esta técnica puede tener un espacio en la medicina reproductiva. Eliminar estas enfermedades de la línea germinal parece un bien incondicional: tanto la persona que se desarrolle a partir del embrión modificado como su descendencia quedarán libres de la enfermedad.
Entonces, ¿qué nos impide alterar los genes de los embriones de FIV para seleccionar o mejorar los rasgos del futuro bebé? ¿Podemos adaptar a la futura niña (porque podemos seleccionar el sexo) para que tenga el pelo de color rojo vibrante y los ojos verdes, sea inteligente y atlética, elegante y con capacidad para la música (una lista de deseos estereotípica para los «bebés de diseño»)?
A menudo estas discusiones son ingenuas en términos genéticos. Rara vez hay una relación única y directa entre los genes y los rasgos, especialmente aquellos que puedan ser objeto de la «selección positiva» (ya sea mediante la edición genética o la selección de embriones FIV utilizando las técnicas actuales de diagnóstico genético preimplantacional, o DGP). La base genética de atributos como la inteligencia o la musicalidad está demasiado dispersa en el genoma, lo que las hace poco susceptibles a la edición genética (incluso el color de ojos, que durante mucho tiempo se pensó que estaba relacionado con unos pocos genes, ha resultado tener una base genética más compleja). Sería necesario modificar cientos, o quizás miles de genes, y esto no solo sería poco práctico, sino que además acarrearía con toda seguridad consecuencias impredecibles en otros rasgos. Los genes no funcionan como sería necesario para permitir la producción fiable y predictiva de «bebés de diseño» más inteligentes, fuertes o atractivos.
En cualquier caso, si hemos de llegar a algo remotamente parecido a la fantasía popular de los bebés de diseño –selección genética por razones no médicas– llegará antes por la selección de embriones mediante DGP que por la edición genética. Según el especialista en bioética Hank Greely, de la Universidad de Stanford, «prácticamente cualquier cosa que puedas hacer con la edición genética se puede conseguir mediante la selección de embriones».
La normalización y liberalización del DGP (algunos países ya lo permiten para seleccionar el sexo del bebé) conllevaría problemas éticos complejos (Greely, 2016). El canto de sirena de seleccionar al «bebé perfecto» por DGP puede llevar las expectativas hasta extremos patológicos. ¿Y si el bebé seleccionado genéticamente para tener una capacidad atlética superior o un gran talento artístico no cumple lo que se promete (como sin duda ocurrirá en alguna ocasión, porque estas predicciones son solo probabilísticas)? Además, una disponibilidad desigual de esta elección para los diferentes sectores socioeconómicos podría alterar seriamente la estabilidad e incluso crear una «brecha genética» social o nacional como la que mostraba la película Gattaca de 1997.
Gámetos artificiales
Debido al gasto, la incertidumbre y el esfuerzo que supone la FIV, parece poco probable que el DGP se convierta en un método reproductivo generalizado a corto plazo, pero esto podría cambiar con la reprogramación celular. Una de las limitaciones clave de la FIV actual es la dificultad de obtener óvulos para la fertilización. Una extracción suele recoger media docena de óvulos utilizables, y no todos ellos se convertirán en embriones viables para la implantación.

La comunidad investigadora internacional quedó sorprendida y consternada cuando, a finales de 2018, el biólogo chino He Jiankui anunció que había utilizado la técnica CRISPR para crear a dos gemelas cuyo genoma había sido modificado para evitar la infección por VIH. En 2020 el científico fue inhabilitado y condenado a tres años de cárcel. En la imagen, He Jiankui explicando los resultados del experimento en un vídeo publicado en noviembre de 2018 en el canal The He Lab en YouTube./ The He Lab
Pero las tecnologías de transformación celular podrían permitirnos crear óvulos in vitro, mediante la reprogramación de células somáticas para convertirlas en gametos. Esto es más complicado que con la mayoría de células, porque los gametos (óvulos y espermatozoides) solo tienen una copia de los cromosomas, en lugar de dos. No se crean por división celular (mitosis), sino por un proceso especial llamado meiosis que reduce a la mitad el número de cromosomas.
No es nada fácil reproducir este proceso en una placa de Petri. Pero la creación de óvulos funcionales a partir de iPSC ya se ha conseguido en ratones. Lo hicieron Mitinori Saitou y su equipo en Kioto (Saitou y Miyauchi, 2016). Primero transformaron iPSC in vitro en precursores de los gametos llamados células germinales primordiales (CGP), que todavía no han pasado por la meiosis y no pueden ser fertilizadas. Luego completaron el proceso de maduración in vivo trasplantando las CGP a los ovarios de ratones vivos. También se han producido espermatozoides «artificiales» de esta forma, trasplantando CGP creados a partir de iPSC a los testículos de ratones adultos. Si funciona en humanos, podría ser el remedio para una baja producción de espermatozoides, una causa habitual de los problemas de fertilidad.
Más allá de la carne
nos que ofrecen las nuevas tecnologías de que disponemos para manipular células pueden parecer excesivas, incluso alarmantes, pero son bastante conservadoras en comparación con lo que algunos científicos pronosticaban en los inicios de esta disciplina. En su ensayo de 1929, titulado The world, the flesh and the devil (“El mundo, la carne y el diablo”), J. Desmond Bernal (1970) discute el potencial de la biotecnología en el futuro y especula y extrapola mucho más de lo que la mayoría de científicos se atreverían a afirmar hoy en día. Según él, más tarde o más temprano conseguiríamos librarnos de «las partes inútiles del cuerpo» y reemplazarlas por aparatos mecánicos: extremidades artificiales y dispositivos sensoriales más avanzados, hasta llegar al punto de ser un cerebro vivo conectado a un «cuerpo» máquina.
Las especulaciones de Bernal se entienden hoy como parte de la herencia intelectual del movimiento llamado transhumanismo, que pretende utilizar la tecnología para extender radicalmente las posibilidades del cuerpo humano. Según Max More, director ejecutivo de la compañía de criónica Alcor Life Extension Foundation, el transhumanismo «intenta continuar y acelerar la evolución de la vida inteligente más allá de la forma y las limitaciones humanas actuales mediante la ciencia y la tecnología, guiado por principios y valores en favor de la vida» (More y Vita-More, 2013, p. 3).
Gran parte del programa transhumanista se ha centrado hasta ahora en extender las capacidades cognitivas y sensoriales utilizando tecnologías médicas y de la información, medicamentos e interfaces humano-máquina. En la actualidad, parece que la propia plasticidad de la carne humana puede convertirla en otra herramienta para los transhumanistas.
«Las ideas transhumanistas desafían nuestra concepción de la identidad y nuestra propia naturaleza»
¿Con qué fin? Los transhumanistas defienden el derecho de los individuos a reimaginar y reconfigurar su cuerpo y su mente, incluyendo el derecho a extender su esperanza de vida y aumentar sus capacidades físicas y mentales. En general muestran una tendencia libertaria: se centran en los derechos del individuo y proyectan posibilidades en clave utópica. Pero la mayoría de narrativas sobre este tipo de esfuerzos tienden más bien hacia la distopía. Uno de los peligros del transhumanismo no es que plantee cuestiones y retos excesivos –eso ya lo hace la biotecnología actual– sino que a los falsos profetas y a aquellos que fantasean con sueños tecnológicos les resulta demasiado fácil apropiarse de él para perseguir sus propias obsesiones.
Pero el movimiento da lugar a reflexiones éticas serias. Ya dedicamos mucho esfuerzo a buscar lo que consideramos una «buena vida»: prolongar el período de tiempo en el que gozamos de buena salud física y mental, cultivar relaciones significativas, aliviar el sufrimiento de otros, respetar la autonomía y los derechos individuales y profundizar en nuestra interacción intelectual y emocional con el mundo. Si las tecnologías médicas y de la información pueden ofrecer nuevas oportunidades en este sentido, ¿cómo no va a ser ético, sabio y responsable aceptar estas oportunidades?
El principio de rediseñar el cuerpo para extender sus capacidades no es más que lo que llevamos siglos practicando, al menos desde el desarrollo de las prótesis y los dispositivos de ayuda a la visión y la audición. Ahora podemos crear extremidades artificiales que respondan a impulsos nerviosos o pantallas de seguimiento ocular, así como dispositivos de radiofrecuencia epidérmicos o implantados que pueden monitorizar y transmitir indicadores fisiológicos. Próximamente, las tecnologías de transformación celular pueden hacer posibles cambios morfológicos mucho más notables en nuestros cuerpos, y la perspectiva transhumanista puede ser una parte útil e incluso esencial del debate sobre qué es posible o deseable. Si nos tomamos en serio estas ideas, hemos de reconocer que van incluso más allá de lo social y lo ético; son también filosóficas y desafían nuestra concepción de la identidad y nuestra propia naturaleza. Nos obligan a reconsiderar qué significa ser humano o, en palabras de la teórica cultural americana Susan Merrill Squier (2004), a «redibujar al ser humano».
Referencias
Aach, J., Lunshof, J., Iyer, E., & Church, G. M. (2017). Addressing the ethical issues raised by synthetic human entities with embryo-like features. eLife, 6, e20674. https://doi.org/10.7554/eLife.20674
Adli, M. (2018). The CRISPR tool kit for genome editing and beyond. Nature Communications, 9, 1911. https://doi.org/10.1038/s41467-018-04252-2
Bernal, J. D. (1970). The world, the flesh and the devil: An enquiry into the future of the three enemies of the rational soul. Jonathan Cape. (Treball original publicat en 1929).
Boland, M. J., Hazen, J. L., Nazor, K. L., Rodriguez, A. R., Gifford, W., Martin, G., Kupriyanov, S., & Baldwin, K. K. (2009). Adult mice generated from induced pluripotent stem cells. Nature, 461, 91–94. https://doi.org/10.1038/nature08310
Greely, H. T. (2016). The end of sex and the future of human reproduction. Harvard University Press.
Greely, H. T. (2021). CRISPR people: The science and ethics of editing humans. MIT Press.
Harrison, S. E., Sozen, B., Christodoulou, N., Kyprianou, C., & Zernicka-Goetz, M. (2017). Assembly of embryonic and extraembryonic stem cells to mimic embryogenesis in vitro. Science, 356(6334), eaal1810. https://doi.org/10.1126/science.aal1810
Kim, J., Koo, B. K., & Knoblich, J. A. (2020). Human organoids: Model systems for human biology and medicine. Nature Reviews Molecular Cell Biology, 21, 571–584. https://doi.org/10.1038/s41580-020-0259-3
Kojima, J., Fukuda, A., Taira, H., Kawasaki, T., Ito, H., Kuji, N., Isaka, K., Umezawa, A., & Akutsu, H. (2017). Efficient production of trophoblast lineage cells from human induced pluripotent stem cells. Laboratory Investigation, 97, 1188–1200. https://doi.org/10.1038/labinvest.2016.159
Li, F., Hu, J., & He, T.-C. (2017). iPSC-based treatment of age-related macular degeneration (AMD): The path to success requires more than blind faith. Genes & Disease, 4(2), 41–42. https://doi.org/10.1016/j.gendis.
2017.03.001
More, M., & Vita-More, N. (Eds.). (2013). The transhumanist reader. Wiley-Blackwell.
Nagoshi, N., Tsuji, O., Nakamura, M., & Okano, H. (2019). Cell therapy for spinal cord injury using induced pluripotent stem cells. Regenerative Therapy, 11, 75–80. https://doi.org/10.1016/j.reth.2019.05.006
Payne, N. L., Sylvain, A., O’Brien, C., Herszfeld, D., Sun, G., & Bernard, C. C. A. (2015). Application of human induced pluripotent stem cells for modeling and treating neurodegenerative diseases. New Biotechnology, 32(1), 212–228. https://doi.org/10.1016/j.nbt.2014.05.001
Pera, M. (2017). Embryogenesis in a dish. Science, 356(6334), 137–138. https://doi.org/10.1126/science.aan1495
Saitou, M., & Miyauchi, H. (2016). Gametogenesis from pluripotent stem cells. Cell Stem Cell, 18(6), 721–735. https://doi.org/10.1016/j.stem.2016.05.001
Simunovic, M., & Brivanlou, A. H. (2017). Embryoids, organoids and gastruloids: New approaches to understanding embryogenesis. Development, 144(6), 976–985. https://doi.org/10.1242/dev.143529
Squier, S. M. (2004). Liminal lives: Imagining the human at the frontiers of Biomedicine. Duke University Press. https://doi.org/10.1215/
9780822386285
Tang, P. C., Hashino, E., & Nelson, R. F. (2020). Progress in modeling and targeting inner ear disorders with pluripotent stem cells. Stem Cell Reports, 14(6), 996–1008. https://doi.org/10.1016/j.stemcr.2020.04.008
Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomodad, K., & Yamanaka, S. (2007). Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 131(5), 861–872. https://doi.org/10.1016/j.cell.2007.11.019
Takahashi, K., & Yamanaka, S. (2006). Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126(4), 663–676. https://doi.org/10.1016/j.cell.2006.07.024