Vacunas y evolución
¿Por qué es importante entender la diversidad genética de los patógenos?
Desde el punto de vista de las intervenciones en salud pública no hay mejor arma que aquella que permite prevenir la transmisión o aparición de la enfermedad. Dentro del campo de las enfermedades infecciosas las vacunas se han convertido en esa arma y han permitido controlar muchas de ellas. Hoy en día hay un gran número de enfermedades infecciosas emergentes para las que no existen vacunas o enfermedades olvidadas que están reemergiendo. Nuevas vacunas se están desarrollando para atacar a los patógenos que están relacionados con ellas. Sin embargo, y a pesar de la importancia del diseño de una buena vacuna, la diversidad genética de los patógenos no se ha tenido siempre en cuenta. El estudio de dicha diversidad puede darnos indicaciones de cómo el patógeno se adapta a la presión del sistema inmune y qué parte de la respuesta inmune es beneficiosa para el hospedador y qué parte para el patógeno. Entender dicha relación permitirá predecir cuán eficaz y universal puede ser una vacuna y ayudará a diseñarlas mejor.
Palabras clave: variación antigénica, tuberculosis, gripe, sistema inmune, enfermedades infecciosas.
Una breve historia de las vacunas
Las enfermedades infecciosas han sido una de las principales lacras de la humanidad. Viviendo en el siglo XXI es difícil darse cuenta del impacto económico, político y militar que han tenido en la historia. A los casos conocidos de las epidemias de viruela en el Nuevo Mundo que llevaron a la muerte a un 25% de la población azteca en un solo año o la muerte de veinticuatro millones de europeos durante los años de la peste negra hay que añadir otros muchos episodios. El proyecto para el canal de Panamá fue inicialmente acometido por Francia, que lo tuvo que abandonar debido en parte a la alta incidencia de la fiebre amarilla y la malaria. De hecho, mientras los Estados Unidos de América lo construían, el 85% de los trabajadores del canal del Panamá fueron hospitalizados en algún momento debido a estas enfermedades. Y la construcción del canal solo fue posible gracias a las medidas de prevención contra los respectivos vectores que acababan de ser identificados en Cuba en los años posteriores a la guerra con España. La mal llamada gripe española mató al 3% de la población mundial entre 1918 y 1920, cinco veces más muertes que las causadas por la Gran Guerra que acababa de terminar. Muchos historiadores culpan a diferentes plagas del deterioro de muchas urbes del Imperio Romano y afirman que ello contribuyó a la caída de este. De hecho, la llamada plaga antoniana (165-185 dC), cuyo agente causante se desconoce (se especula que era la viruela), se cree que mató a cinco millones de habitantes del imperio, mientras que la llamada plaga justiniana azotó al Imperio Bizantino (541-542 dC). El mismo Napoleón hizo vacunar a todo su ejército contra la viruela y alabó públicamente a Edward Jenner por el desarrollo de la vacuna a pesar de ser ciudadano de un país enemigo.
El virus de la gripe estacional es del tipo H3N2. Sin embargo esto es así solo desde 1968, cuando H3N2 desplazó al subtipo anterior (H2N2). Además muchos otros tipos de menor frecuencia siguen circulando hoy en día (H1N1, H1N2). / Agencia SINC
Las causas de muchas enfermedades infecciosas solo se empezaron a esclarecer cuando en 1680 la Royal Society de Londres reconoció públicamente las observaciones de un científico holandés, Antonie van Leeuwenhoek, sobre la existencia de organismos microscópicos unicelulares. Que pudieran existir «entidades» que causaran las grandes epidemias ya había sido propuesto antes incluso que las observaciones de Leeuwenhoek por personajes como Girolamo Fracastoro. Pero fue el trabajo del holandés y más tarde de científicos como Semmelweis (en el campo de la higiene) y de John Snow (en el campo de la epidemiología) los que sirvieron de apoyo a la formulación de la llamada teoría del germen. Dicha teoría postulaba que muchas de las enfermedades más comunes eran realmente debidas a infecciones por microorganismos y consiguió un respaldo definitivo con los trabajos de Louis Pasteur y Robert Koch. Muchos de los agentes causantes de las mayores epidemias fueron descritos en el siglo XIX o principios del XX e identificarlos llevó a una época de innovación en la prevención, diagnóstico y tratamiento de las enfermedades infecciosas (De Kruif, 1926). Como consecuencia de todo ello, la segunda mitad del siglo XX se caracterizó si no por la erradicación, sí por el desplazamiento de las enfermedades infecciosas como la principal causa de morbidez al menos en los países desarrollados. En este sentido existe un consenso general en que el desarrollo de vacunas y las campañas de vacunación masiva, muchas de ellas promovidas a nivel mundial, han salvado millones de vidas y virtualmente erradicado muchas enfermedades (Nabel, 2013). Un papel central en la historia de la investigación en vacunas lo ocupa una enfermedad a la que se le imputa la muerte de cientos de millones de personas a lo largo de la historia, la viruela.
Al contrario de lo que se piensa, el proceso de inocular patógenos en las personas para generar una respuesta inmune protectora a futuras exposiciones no empezó con Edward Jenner, el médico británico al cual se atribuye correctamente el desarrollo de la primera vacuna. Los primeros casos de inoculación antivariólica son atribuidos a una monja budista alrededor del año 1020 dC. Según ha quedado recogido, la monja muestreaba restos de las heridas de pacientes de viruela y los introducía en las fosas nasales de personas no enfermas, con lo que conseguía un cierto grado de protección contra nuevas infecciones. En la Inglaterra del siglo XVIII la versión bovina de la enfermedad era tan importante económicamente como mortal lo era la versión humana. El trabajo con ambas llevó a Edward Jenner a desarrollar y probar exitosamente la primera vacuna contra la viruela y de la historia a partir de la versión bovina de la enfermedad. La vacuna no solo representó un hito científico que abrió el camino hacia otros muchos sino que además supuso el inicio de actuaciones de salud pública a gran escala, lo que convierte a la viruela en el mayor ejemplo de erradicación de una enfermedad a partir de planes coordinados de vacunación masiva. Ali Maow Maalin, en 1977, a la edad de 23 años, residente en Merca (Somalia), se convirtió en el último caso oficial de viruela en el mundo y el primer gran éxito de la Organización Mundial de la Salud (OMS) en la erradicación de las enfermedades infecciosas. El éxito con la vacunación de la viruela y en mayor o menor medida de enfermedades como la polio, rubeola, parotiditis o la difteria no ha impedido, sin embargo, que todavía hoy muchas enfermedades infecciosas sigan siendo comunes o hayan resurgido y nuevas aproximaciones al desarrollo de vacunas se hagan necesarias.
«La identificación de agentes abrió una época de innovación en la prevención, diagnóstico y tratamiento de enfermedades infecciosas»
El punto de vista del patógeno
Una posible causa del fallo en el diseño de vacunas es que para muchas de ellas no se ha tenido en cuenta la diversidad genética del patógeno y su capacidad de adaptarse a nuevas presiones de selección como son las vacunaciones o el uso de antibióticos. Desde el punto de vista genético, los patógenos, al igual que las poblaciones humanas, no son homogéneos, han acumulado cambios a lo largo de su historia evolutiva. Hay patógenos con una alta diversidad genética, que incluso presentan tipos patógenos y no-patógenos, como es el caso de Escherichia coli, y patógenos muy especializados con muy baja diversidad, como es el caso de los bacilos de la lepra y la tuberculosis o la bacteria de la peste. Algunos presentan un alto nivel de recombinación, por ejemplo Neisseria meningitidis y algunos virus, mientras que otros son genéticamente monomórficos. En el contexto de las vacunas esta variación preexistente debe ser tenida en cuenta, así como la capacidad del patógeno de mutar y encontrar variaciones de escape a la acción del sistema inmune o de la protección conferida por las vacunas. Todos estos aspectos relacionados con la evolución del patógeno pueden afectar al desarrollo y a la universalidad de nuevas vacunas. Para ilustrar el impacto de la evolución en el diseño de vacunas, vamos a ver dos ejemplos muy diferentes: el caso de la vacuna de la gripe y el de la vacuna de la tuberculosis.
El éxito con la vacunación de la viruela y otras enfermedades no ha impedido que todavía hoy muchas enfermedades infecciosas sigan siendo comunes o hayan resurgido y nuevas aproximaciones al desarrollo de vacunas se hagan necesarias. / Aki Hänninen
La gripe: evadiendo la respuesta inmune
Los virus en general y los basados en ARN en particular son los típicos ejemplos de organismos que evolucionan a tal velocidad que son capaces de encontrar soluciones a muchos de los desafíos que les ponemos para prevenirlos y tratarlos. Sin embargo no son solo sus altas tasas de mutación o de recombinación el secreto de su éxito, sino también los grandes tamaños poblacionales, que les permiten encontrar las soluciones evolutivas más óptimas con mayor rapidez. Dicha alta variabilidad tiene consecuencias directas en el diseño de fármacos y vacunas para tratar o prevenir la infección. Un caso paradigmático, quizá el más estudiado, es el de la vacuna usada cada año para la gripe estacional.
El reservorio natural para todos los virus de la gripe, ya sea esta estacional o epidémica, son las aves. Los virus de la gripe que afectan a humanos son conocidos como tipo A y generalmente son diferenciados en base a la combinación de dos de sus proteínas, HA (hemaglutinina) y NA (neuramidasa). Dichas proteínas son reconocidas por el sistema inmune, en otras palabras, son antígenos. Cada evento importante de recombinación que ha generado nuevas combinaciones de estas dos proteínas ha llevado aparejado un cambio radical en su antigenicidad, dando lugar a episodios pandémicos más o menos relevantes. Esto es lo que ocurrió con el virus de 1918, que se estima mató a 50 millones de personas globalmente y que comúnmente es conocido como el virus de la gripe española. Así, por ejemplo, el virus de la gripe que nos afecta todos los años (también conocida como gripe estacional) es del tipo H3N2. Sin embargo esto es así solo desde 1968, cuando H3N2 desplazó al subtipo anterior (H2N2). Además muchos otros tipos en menor frecuencia siguen circulando hoy en día (H1N1, H1N2).
«La vacuna contra la viruela significó el inicio de actuaciones de salud pública a gran escala»
De lo expuesto anteriormente queda clara la gran capacidad del virus de la gripe para generar diversidad antigénica. De hecho, atendiendo al mecanismo involucrado y sobre todo a las consecuencias de la acumulación de dicha variación, se suele diferenciar entre episodios de «deriva antigénica» y episodios de «desplazamiento antigénico» (Rambaut et al., 2008). A los últimos me he referido ya y son los que generalmente llevan aparejados un cambio radical en la composición antigénica del virus. Debido a que la población general no ha sido expuesta anteriormente a dicha nueva combinación el resultado son pandemias de mayor o menor gravedad. Históricamente se distinguen cinco grandes pandemias, incluyendo la más reciente conocida como gripe A, producida por un virus tipo H1N1.

A) Distribución global de los principales linajes dentro del complejo de la tuberculosis. Los colores indican el linaje dominante en las diferentes zonas geográficas. / Extraída de Comas i Gagneux, 2009. B) Los epítopos conocidos de M. tuberculosis son la parte más conservada del genoma del patógeno y sugieren que la tuberculosis no sigue una estrategia de evasión del sistema inmune sino que se aprovecha de este para transmitirse. / Adaptado de Comas et al., 2010.
Al contrario de lo que ocurre cuando el virus cambia totalmente su composición antigénica, la gripe estacional debe enfrentarse al hecho de que la infección a una persona genera un cierto grado de inmunidad protectora que limita el número de personas susceptibles al mismo tipo de virus cada año. La manera en la que el virus evade a poblaciones con una alta inmunidad adquirida es haciendo valer su alta tasa de mutación y tamaños poblaciones, que le permiten encontrar variaciones aminoacídicas que evadan la inmunidad adquirida por infecciones previas. El resultado de esto es que el virus de la gripe estacional es ligeramente diferente cada año como resultado de acumular variaciones de escape al sistema inmune (figura 1). Es este cambio continuo lo que hace que la vacuna recomendada contra la gripe no pueda ser la misma cada año. Un comité de expertos decide anualmente cuál es la mejor combinación de antígenos para generar inmunidad general, basada en los datos de los tipos de gripe que han circulado en los años anteriores. Por poner un ejemplo, para el año 2013 la OMS ha recomendado que la vacuna esté compuesta por una mezcla de antígenos de una cepa detectada en el 2009 de H1N1, otra del 2011 de H3N2 y otra para la menos común pero presente en muchos países de gripe tipo B, del 2010.
«El virus de la gripe estacional es ligeramente diferente cada año como resultado de acumular variaciones de fuga al sistema inmune»
La tuberculosis: manipulando la respuesta inmune
Un caso especial en cuanto al impacto de la diversidad del patógeno en la respuesta inmune lo constituye el bacilo de la tuberculosis. Entre 1908 y 1921 dos microbiólogos del Instituto Pasteur, Calmette y Guérin, aislaron y cultivaron mediante pases seriados el bacilo de la tuberculosis bovina para crear una cepa atenuada que se pudiera usar para inmunizar contra la infección tuberculosa en humanos. Dicha cepa atenuada es conocida como el bacilo de Calmette y Guérin (BCG) y es la vacuna más usada en la historia. La versión bovina de la tuberculosis está causada por Mycobacterium bovis, que forma parte del conocido como complejo de la tuberculosis junto con otros bacilos que provocan tuberculosis en animales pero raramente en humanos y los bacilos que prácticamente solo provocan tuberculosis en humanos (Mycobacterium tuberculosis y Mycobacterium africanum). A pesar de que todos ellos poseen diferentes nombres específicos, las diferencias a nivel genómico son tan pequeñas (alrededor de 2.000 cambios nucleotídicos como máximo) que hoy en día serían considerados una sola especie. Cuando Calmette y Guérin desarrollaron la vacuna a partir de una cepa virulenta de la tuberculosis bovina no sabían que durante el proceso de pases en el laboratorio (en rodajas de patata suplementadas con glicerol) se produjeron una serie de cambios a nivel genómico que fueron aumentados cuando la cepa de la vacuna fue distribuida a laboratorios de todo el mundo. Debido a que en aquella época no existían métodos para mantener las muestras congeladas, los laboratorios realizaron pases seriados para conservarlas. El resultado es que diferentes cepas de la vacuna acumularon diferentes mutaciones en su genoma, lo que dio lugar a una genealogía que permite seguir la evolución de la vacuna durante los últimos noventa años. De esta manera la vacuna contra la tuberculosis se convirtió involuntariamente en un experimento de evolución que duró décadas. Sin embargo la vacuna de la tuberculosis no es efectiva contra la forma más contagiosa y común de la enfermedad, la tuberculosis pulmonar en adultos. Sí lo es, y de ahí que se hagan campañas de vacunación masiva con BCG en los países con alta incidencia de tuberculosis, contra las formas extrapulmonares de la enfermedad en niños.
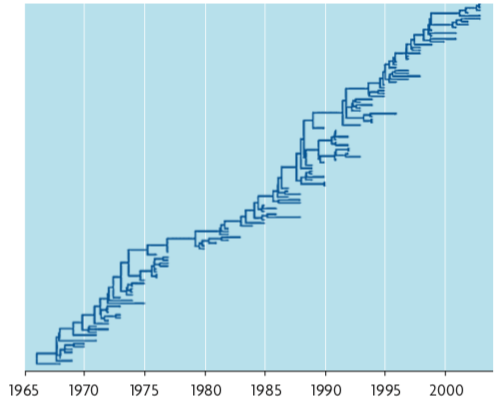
Figura 1. Árbol filogenético de una región del gen HA de la gripe A (H3N2) a partir de muestras de virus obtenidas entre 1968 y 2002. El árbol refleja un linaje predominante del que se derivan ramas secundarias que duran unos pocos años. El linaje central refleja la adaptación del antígeno del virus a lo largo del tiempo como respuesta a la acción del sistema inmune. / Fuente: PLoS Comput Biol
Como hemos visto en el caso de la gripe, la mayoría de patógenos de una manera u otra acumula cambios en aquellas zonas o proteínas del genoma que son reconocidas por el sistema inmune durante la infección. Dichas proteínas son conocidas como antígenos y los cambios en ellos acumulados se asocian a la variación antigénica, que permite al patógeno evadir las defensas humanas. Sin embargo, el caso de la tuberculosis es especial. Un estudio basado en tecnologías de secuenciación masiva sobre un conjunto de cepas representativas de la diversidad conocida del bacilo ha revelado que los antígenos, y concretamente los fragmentos peptídicos reconocidos por el sistema inmune conocidos como epítopos, están hiperconservados en Mycobacterium tuberculosis (Comas et al., 2010). De hecho si se compara con los genes esenciales, genes que no se pueden eliminar en el patógeno porque son necesarios para sobrevivir, los epítopos están igual o mejor conservados y acumulan menos cambios aminoacídicos que los genes no-esenciales u otras zonas no reconocidas por el sistema inmune. Sin embargo, por experimentos con ratones sabemos que la respuesta inmune adaptativa y sobre todo la mediada por células T CD4+ es esencial para contener la infección. ¿Por qué el bacilo de la tuberculosis no trata de evadir dicha respuesta aprovechando cambios en la secuencia de sus epítopos? La respuesta más sencilla es porque en el caso de la tuberculosis el patógeno necesita de la respuesta inmune para transmitirse. La respuesta inmune permite al bacilo completar su ciclo de infección, primero induciendo un estado de latencia y más tarde sobrerreaccionando en el 5-10 % de los casos en los que la bacteria se reactiva. Es, de hecho, la reacción inflamatoria parte de la causante del daño en los tejidos del pulmón que son expulsados, junto con el patógeno, al estornudar, lo que les permite transmitirse. Este ciclo vital indica que, si bien la respuesta inmune en parte beneficia al hospedador, también parece que parte de esa reacción beneficia al patógeno. De hecho los pacientes VIH positivos con bajos niveles de CD4+ presentan con más frecuencia formas extrapulmonares, no transmisibles de la enfermedad, así como una menor carga bacilar en el esputo. Esto indica que una correcta respuesta inmune es necesaria para contener la infección en el pulmón en primer lugar y para la posterior transmisión en los casos en los que la bacteria se reactiva de la infección latente.
«La vacuna contra la tuberculosis se convirtió involutariamente en un experimento de evolución que duró décadas»
Conseguir una vacuna eficaz contra la tuberculosis pulmonar se ha convertido en uno de los principales objetivos de la OMS en los últimos treinta años. Aunque la tuberculosis se puede curar si se sigue el tratamiento, se estima que un tercio de la población mundial está infectada de forma latente y que alrededor de un 10% presentará síntomas de tuberculosis activa en algún momento de su vida. Esto indica que, si bien los casos activos pueden ser tratados con antibióticos, en términos de coste-beneficio sería mucho más efectiva una vacuna que en primer lugar evitara la infección o que al menos impidiera la reactivación de la infección latente. Más de diez candidatos están actualmente en diferentes fases de desarrollo, algunos de ellos siendo ya probados en ensayos clínicos con humanos. Sin embargo, la tuberculosis es una enfermedad compleja. De su agente causante, a pesar de haber sido descubierto hace más de cien años, sabemos todavía poco, así como de la interacción entre la bacteria y el sistema inmune durante la infección. La llegada de la secuenciación genómica y más recientemente de las tecnologías de secuenciación masiva está permitiendo entender en toda su extensión la diversidad de este patógeno, lo que ha llevado a nuevos conocimientos sobre su transmisión, evolución y, para el tema que nos ocupa, su respuesta al sistema inmune.
La vacuna de la tuberculosis no es efectiva contra la forma más contagiosa y común de la enfermedad, la tuberculosis pulmonar en adultos. Sí lo es, y de ahí que se hagan campañas de vacunación masiva con BCG en los países con alta incidencia de tuberculosis, contra las formas extrapulmonares de la enfermedad en niños. En la imagen, una campaña de inmunización en Delhi (India). / OMS / P. Virot
Estos resultados permiten también entender por qué la eficacia de la vacuna BCG es tan desigual, puesto que la forma bovina del bacilo a nivel genómico no es esencialmente muy diferente del bacilo de la tuberculosis humana. De hecho es una bandera roja en el diseño de vacunas que intenten usar algunos de estos epítopos hiperconservados, pues en parte pueden favorecer al patógeno, no al hospedador. Por lo tanto, al contrario que otras aproximaciones para el diseño de vacunas que buscan identificar las regiones más conservadas del genoma (conocida como vacunología reversa), puede que, en el caso de la tuberculosis y otras infecciones similares, deban ser buscados nuevos antígenos, basados en regiones hipervariables del genoma, que reflejen una verdadera acumulación de variación de escape en respuesta al sistema inmune. Estrategias similares a las usadas por Mycobacterium tuberculosis para aprovechar parte de la respuesta inmune para completar su ciclo vital han sido recientemente descritas para otros patógenos como el VIH o Streptococcus pneumoniae.
Los dos casos analizados, así como otros muchos, llevan a una consideración esencial. En un patógeno la variación existe y cuando se diseñan nuevas vacunas cabe preguntarse varias cosas: ¿Cuál es la naturaleza de la variación preexistente? ¿Está dicha variación unida a presiones selectivas inmunes o de vacunaciones? ¿Cuál es la capacidad del patógeno de adaptarse ante nuevas presiones de selección? Respondiendo a estas preguntas se podrán diseñar mejores vacunas a través de un mejor conocimiento de la interacción del sistema inmune y el patógeno, lo que nos permitirá distinguir entre aquellos elementos que forman parte de la respuesta inmune protectora frente a aquellas interacciones que pueden beneficiar al patógeno.
REFERENCIAS
Comas, I. i S. Gagneux, 2009. «The Past and Future of Tuberculosis Research». PLoS Pathogens, 5(10): e1000600. doi: 10.1371/journal.ppat.1000600.
Comas, I. et al., 2010. «Human T Cell Epitopes of Mycobacterium tuberculosis Are Evolutionarily Hyperconserved». Nature Genetics, 42(6): 498-503. doi: 10.1038/ng.590.
De Kruif, P., 1926. Microbe Hunters. Harcourt, Brace and Co. Nova York.
Nabel, G. J., 2013. «Designing Tomorrow’s Vaccines». The New England Journal of Medicine, 368(6): 551-560. doi: 10.1056/NEJMra1204186.
Rambaut, A. et al., 2008. «The Genomic and Epidemiological Dynamics of Human Influenza A Virus». Nature, 453(7195): 615-619. doi: 10.1038/nature06945.