La Asamblea General de la ONU proclamó el 2011 como el Año Internacional de los Bosques y el Año Internacional de la Química, dos conmemoraciones que son el detonante de nuestra colaboración en este número de primavera. Ayudadas por nuestro asesor químico y autor de la sección «La ciencia en la mesa» en Mètode, Fernando Sapiña, hemos preparado una actividad que reúne las dos celebraciones: un sorprendente bosque químico.
El Año Internacional de los Bosques resultará útil para tomar mayor conciencia de que los bosques son parte integrante del desarrollo sostenible del planeta gracias a los beneficios económicos, socioculturales y ambientales que proporcionan. España tiene 14,4 millones de hectáreas de bosques, lo que convierte a nuestro país en el cuarto de Europa con mayores recursos forestales tras Suecia, Finlandia y Francia. El 88% de la superficie forestal de España tiene como función principal la protección contra la erosión del suelo y la desertificación, así como la regulación del ciclo hidrológico. El 12% restante son bosques productivos, que suministran gran parte de la madera que consume España.
Por su parte, el Año Internacional de la Química se celebra este año bajo el lema «Química: nuestra vida, nuestro futuro». Los objetivos de esta conmemoración son diversos: incrementar la valoración pública de la química como herramienta fundamental para satisfacer la necesidad de la sociedad, promover el interés por la química entre los jóvenes y generar entusiasmo por el futuro creativo de la química. Todo esto cuando se cumplen cien años del premio Nobel de Química otorgado a Marie Curie.
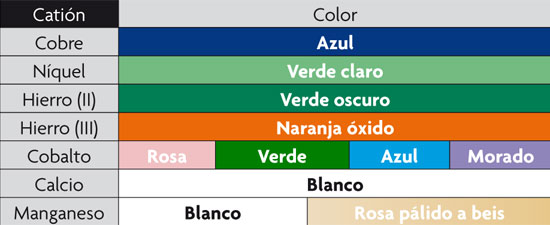
En este cuadro se muestran los colores que conseguirás utilizando cada una de las sales de metales enumeradas en la lista de materiales.
Actividad: Crear un bosque químico
Esta versión del bosque químico la hemos experimentado y la presentamos con las posibilidades reales de llevarla a cabo.
¿Qué es lo que pasa?
1. Cuando ponemos en contacto cristales de una de las sales, por ejemplo, de cloruro de cobalto (color vino), con una disolución de silicato sódico (vidrio líquido) en agua, el cristal se empieza a disolver y los cationes (+) cobalto reaccionan con los aniones (–) silicato para formar un gel de silicato de cobalto (color azul).
2. A medida que entra el agua en la zona interior del gel por ósmosis, se disuelve el cristal, aumenta la presión interna y, en un momento dado, el gel se rompe: por el punto de ruptura sale hacia afuera la disolución de cloruro de cobalto.
3. Como esta disolución es menos densa que la disolución de silicato, se desplaza hacia arriba desde el punto de ruptura. La reacción entre los cationes cobalto y los aniones silicato produce de nuevo más gel de silicato de cobalto. Así se van formando tubos de diferentes tamaños, colores y formas, en función de la naturaleza de la sal añadida, hacia arriba del bote, tubos que recuerdan troncos de árboles, y la combinación de los distintos troncos evoca la imagen de un bosque. También podéis aprovechar para conocer el concepto de ósmosis y las claves del experimento de Arquímedes.
Materiales
—Silicato de sodio (vidrio líquido o vidrio soluble). Es fácil de encontrar en droguerías y tiendas de pintura.
—Vaso de vidrio reciclado y una probeta o vaso medidor.
—Agua destilada.
—Sales de metales en polvo o granuladas: Sulfato de cobre pentahidratado (Cu S O4, 5H2 O), sulfato de níquel heptahidratado (Ni S O4, 7H2 O), sulfato de hierro (II) heptahidratado (Fe S O4, 7H2 O), cloruro de hierro (III) (Fe Cl3 ) o cloruro de cobalto hexahidratado (Co Cl2, 6H2 O), cloruro de calcio (Ca Cl2) o sulfato de manganeso monohidratado (Mn S O4, H2 O).

Algunos resultados de la actividad.
Procedimiento
—Preparamos la solución con dos medidas de agua por una de silicato. Hay que ir con cuidado, el silicato se llama vidrio líquido y cuando se seca puede cortar.
—Lo mezclamos bien.
—Con una espátula, espolvoreamos la sal y la distribuimos por el bote.
—Esta se hundirá y empezará a crecer. Se puede repetir con otra en otro bote. ¡Puedes experimentar!
—Después de unos segundos, empezarán a crecer como unos hilos, semejantes a briznas de hierba. Dependiendo de la sal, se forman diferentes estructuras y diferentes colores (ved el cuadro).
—El bosque completa su crecimiento en 30 minutos.
Advertencia. Esta solución no se conserva bien al aire libre y hay que taparla con una película de plástico transparente. Tampoco se debe introducir nunca en el acuario, ya que es muy perjudicial para los peces.
Si queréis conservar el bosque se puede cambiar el silicato por aceite corporal. Si coláis el silicato para quitarle impurezas, podéis utilizarlo de nuevo.
Para saber más:
Science amusante.
Science and Plants for Schools.
WikiCiencia.