 |
||
|
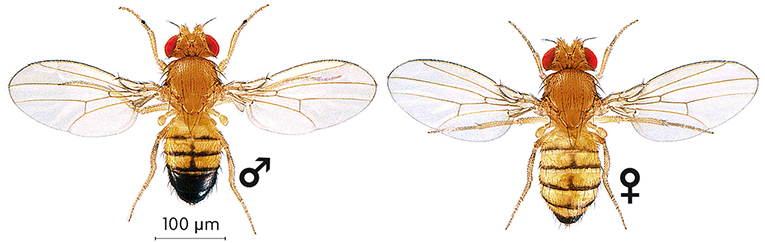
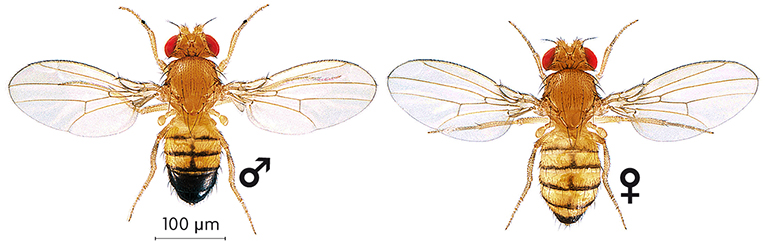
El uso de la mosca del vinagre(Drosophila melanogaster) como organismo de experimentación comenzó hace más de un siglo. Desde entonces, la introducción de animales modelo en investigación ha sido esencial para ayudar a comprender la función de los genes y cómo estos se integran en distintos procesos biológicos. Hasta hace poco, la mosca Drosophila se ha empleado casi exclusivamente en la investigación básica, pero progresivamente se está convirtiendo en un organismo cada vez más empleado en investigación biomédica. Más del 60% de los genes involucrados en enfermedades humanas, así como el 70% de los genes relacionados con el cáncer, presentan un homólogo en Drosophila. Además, el genoma de esta pequeña mosca se puede considerar una versión compacta y simplificada del genoma humano. El alto grado de conservación permite a los investigadores estudiar la función de genes causantes de enfermedad usando modelos genéticos en moscas y extrapolar estos descubrimientos a modelos vertebrados y a humanos. Por otro lado, el estudio de enfermedades humanas (Parkinson, Huntington o Alzheimer) en moscas modelo ha permitido estudiar las rutas patogénicas de la enfermedad y ha proporcionado nuevas dianas para el desarrollo de fármacos eficaces contra estas enfermedades. Nuestra salud y los genes de una mosca Los 46 cromosomas humanos albergan casi 3.000 millones de pares de bases de DNA organizados en aproximadamente 20.000-25.000 genes codificantes de proteínas. Cuando alguno de estos genes sufre una mutación suelen producirse alteraciones moleculares que se manifiestan en una patología. Muchas enfermedades comunes en la población tienen una base genética, como la predisposición a la diabetes, al asma, al cáncer o a enfermedades mentales. Otras enfermedades genéticas son el resultado de la mutación en un solo gen, como la enfermedad de Huntington. En todos estos casos, al drama personal y familiar que las acompaña hay que sumar el coste sanitario de los tratamientos, normalmente sintomáticos y crónicos. ¿Qué puede aportar un pequeño insecto de apenas 2 milímetros al desarrollo de tratamientos eficaces y posibles curas? Drosophila melanogaster es un insecto inofensivo tanto para humanos como para plantas. Estas moscas pasan desapercibidas para la mayoría de las personas –se alimentan de frutas en descomposición–, pero constituyen una herramienta fundamental para la investigación genética. La principal ventaja radica en que el estudio de cualquier proceso biológico en moscas se ve simplificado respecto al estudio en vertebrados, en términos de tiempo y coste. Además, hay una gran variedad de herramientas genéticas para Drosophila que permiten eliminar genes, expresarlos en tejidos en los que habitualmente no se encuentran, marcar células individuales o buscar genes relacionados funcionalmente con uno dado, entre otras posibilidades. Disponer de organismos de experimentación como Drosophila es especialmente importante en los estudios biomédicos, ya que la secuencia completa del genoma humano tan solo nos permite tener acceso a las palabras que constituyen las instrucciones genéticas, pero no al significado de dichas instrucciones. Para conocer el funcionamiento de nuestro genoma es necesario abordar de manera experimental el estudio de la función de cada gen y de sus relaciones con otros genes y con el ambiente. El 75% de los genes humanos implicados en enfermedades se pueden identificar en la mosca, donde su función básica está conservada. Así, en la mayoría de ocasiones, las mutaciones en los genes de la mosca homólogos a los responsables de enfermedades humanas (con el mismo origen y, generalmente, con la misma función) provocan alteraciones (lo que se conoce como fenotipo mutante) comparables a los síntomas observados en pacientes. La disponibilidad de moscas que reproducen aspectos de una enfermedad humana aporta un modelo mediante el cual buscar nuevas terapias potenciales e investigar la ruta de patogénesis de esa enfermedad. El ciclo de vida de Drosophila es de tan solo once días a 25 ºC, lo cual permite completar experimentos con relativa rapidez. Así, mientras la neurodegeneración característica de la enfermedad de Alzheimer o de Parkinson puede tardar meses o años en aparecer en modelos en ratones, estas alteraciones aparecen en unas pocas semanas en Drosophila. |
© N. Gomple, 2008 «Muchas enfermedades comunes en la población tienen una base genética, como la predisposición a la diabetes, al asma, al cáncer o a enfermedades mentales» |
|
 © Juan Manuel Fernández Costa El uso de la mosca del vinagre (Drosophila melanogaster) como sujeto de investigación está muy extendido en la investigación básica y cada vez más en la biomédica. Arriba, una investigadora de la Universitat de València observa fenotipos de Drosophila con la lupa. Las moscas se anestesian con un sistema de CO2, como en la imagen de la derecha, para permitir observarlas bajo la lupa. Una vez las moscas se devuelven a las botellas con su medio nutritivo, estas se despiertan a los pocos segundos. |
«La principal ventaja de Drosophila melanogaster radica en que el estudio de cualquier proceso biológico se ve simplificado respecto al estudio en vertebrados» | |
|
Morir por una causa: las enfermedades neurodegenerativas Las enfermedades neurodegenerativas se caracterizan por el deterioro del funcionamiento de las neuronas y son de curso lento y progresivo. Su incidencia en las poblaciones humanas ha sufrido un alarmante incremento a la par que la esperanza de vida ha aumentado. Un gran número de trastornos neurodegenerativos tienen su base en mutaciones que afectan al plegamiento de proteínas concretas, lo que hace que se acumulen de manera tóxica en las neuronas. Biológicamente, la arquitectura del sistema nervioso de Drosophila se asemeja a la de los mamíferos, con áreas que separan funciones especializadas como la visión, el aprendizaje y la memoria. Además, muchos de los genes humanos relacionados con procesos neurodegenerativos tienen homólogos en la mosca, con lo que no es de extrañar que estos modelos en Drosophila fueran pioneros. La enfermedad de Huntington George Huntington describió en 1872 una enfermedad caracterizada por la pérdida progresiva de las funciones cognitivas y cambios de personalidad, así como por movimientos faciales y corporales espasmódicos. Su causa genética radica en una expansión repetitiva de una secuencia de tres nucleótidos, del tipo CAG, en el gen Huntingtina. Los ribosomas de la célula, encargados de la síntesis de proteínas utilizando la información codificada en los ARN mensajeros (ARNm), traducen estos tripletes CAG a glutaminas (abreviadas como Q), uno de los veinte aminoácidos que constituyen las proteínas. Así, mientras que la proteína huntingtina contiene de manera normal unas 8-25 glutaminas seguidas, los enfermos de Huntington poseen proteínas huntingtina con 40 o más glutaminas repetidas. La existencia de expansiones de glutaminas en al menos otras diez patologías (entre las que se incluyen, además, varias ataxias espinocerebelosas, la atrofia muscular espinobulbar y la atrofia dentatorubro-palidoluisiana) ha llevado a agruparlas en una única categoría de trastornos neurodegenerativos que comparten ciertas características, conocidas como enfermedades poliQ. La naturaleza y el comportamiento común de las mutaciones debidas a la expansión de secuencias CAG llevó a los investigadores a diseñar una variante mutante del gen Huntingtina e introducirla en el genoma de Drosophila, con el fin de generar un modelo dondeestudiar la neurodegeneración típica de las enfermedades poliQ. Las moscas modificadas genéticamente que expresaban la proteína huntingtina mutante presentaban neurodegeneración, tal y como ocurre en enfermos de Huntington, y reproducían varios aspectos importantes de la enfermedad. En primer lugar, la patogenicidad de las repeticiones de glutaminas dependía de la longitud de la expansión. Así, las repeticiones de hasta 27 glutaminas no causaban síntomas en humanos ni en las moscas, mientras que las repeticiones de más de 40 glutaminas los provocaban en ambos. Como en las enfermedades neurodegenerativas humanas, en Drosophila la degeneración era evidente en estadios tardíos del desarrollo, apareciendo a menudo en los adultos, y era progresiva (las moscas que expresaban esta proteína perdían neuronas fotorreceptoras durante toda su vida, llegando a morir prematuramente). Así mismo, la presencia de agregados de proteínas en las neuronas, característica de la enfermedad de Huntington, también aparecía en el cerebro de estas moscas. Este modelo de enfermedad de Huntington desarrollado en Drosophila ha permitido comprobar la implicación y el mecanismo de acción de ciertas proteínas en la patogénesis de la enfermedad, proporcionando nuevas dianas potenciales para tratarla. |
«El modelo de enfermedad de Huntington desarrollado en Drosophila ha permitido comprobar la implicación y el mecanismo de acción de ciertas proteínas en la patogénesis de la enfermedad» |
|
|
|
||
ARN tóxicos responsables de la distrofia miotónica Entre las enfermedades causadas por expansiones de secuencias cortas existe un grupo en el que las repeticiones se localizan en regiones no codificantes de los genes (en los genes existen regiones codificantes que determinan la secuencia de aminoácidos en las proteínas, y regiones no codificantes con otras funciones reguladoras) como es el caso de la distrofia miotónica, cuyas bases moleculares estudiamos en el Grupo de Genómica Traslacional de la Universitat de València. La distrofia miotónica es la forma más común de distrofia muscular adulta. Esta enfermedad afecta principalmente al tejido muscular produciendo miotonía (dificultad para relajar la musculatura después de una contracción voluntaria) y debilidad muscular, aunque al ser multisistémica estos síntomas se presentan normalmente asociados con otros, tales como cataratas iridiscentes, arritmias cardíacas o trastornos gastrointestinales. La mutación responsable de la distrofia miotónica se localiza en una región no codificante del gen DMPK (Dystrophia Myotonica Protein Kinase) y consiste en repeticiones de la secuencia CTG. En condiciones normales, de estos tripletes se encuentran entre 5 y 37 copias, mientras que en los pacientes de distrofia miotónica el número de copias aumenta llegando incluso a las 3.000. Diversos modelos animales de la enfermedad, incluido un modelo en Drosophila generado por nuestro grupo, han permitido demostrar que la distrofia miotónica se origina porque los ARNm con gran número de secuencias CTG resultan tóxicos para la célula, independientemente de la proteína que codifican, lo cual constituye un mecanismo de patogénesis novedoso. ¿Por qué resultan estos ARNm tóxicos? Se sabe que distintas proteínas críticas para el metabolismo de los ácidos nucleicos se unen de forma anormal a estos ARNm, quedando secuestradas sin poder realizar su función normal en el núcleo celular. De entre todas ellas, el secuestro de una serie de proteínas denominadas muscleblind es crítico para el desarrollo de síntomas en la enfermedad. ¿Qué ocurre si expresamos la mutación humana en moscas? En nuestro grupo hemos generado moscas transgénicas que expresan 480 repeticiones de la secuencia CTG en distintos tejidos de Drosophila. Sorprendentemente, aunque nunca se ha descrito en este insecto una mutación de este tipo, la expresión de un ARNm compuesto exclusivamente por repeticiones CTG reproduce aspectos moleculares, histológicos y degenerativos típicos de la enfermedad humana. No solo esta mutación es capaz de alterar el funcionamiento de las células del insecto sino que una copia del gen humano Muscleblind es capaz de funcionar en Drosophila. Ambos experimentos constituyen un ejemplo de lo que podríamos denominar la «humanización» del genoma de Drosophila, la cual está contribuyendo a entender mejor algunas patologías humanas y puede ayudar a encontrar terapias para los pacientes afectados por ellas. En la actualidad, el desarrollo de un fármaco hasta su comercialización cuesta más de 800 millones de dólares y supone una media de quince años hasta que se pone en el mercado. Gran parte de este coste proviene de la falta de efectividad o toxicidad de los compuestos candidatos en las etapas preclínicas o clínicas de su desarrollo. Por esta razón, existe un tremendo interés por identificar en estadios tempranos compuestos con potencial terapéutico para el tratamiento paliativo de enfermedades genéticas. Realizar directamente una búsqueda in vivo y a gran escala de compuestos en un organismo invertebrado sencillo como Drosophila permite no solo identificar moléculas que mejoren un aspecto de la patología, sino también clasificarlas de acuerdo con sus características farmacológicas. Un compuesto, además de tener una actividad biológica específica sobre un proceso celular alterado en una patología, debe poseer unas propiedades farmacológicas óptimas, como una buena absorción, distribución o baja toxicidad, entre otras. Muchos ensayos in vitro o en cultivo celular no tienen en cuenta estas características farmacológicas por las limitaciones inherentes a los sistemas empleados. En este sentido, las búsquedas de fármacos en Drosophila son doblemente exigentes. Por un lado, se pide a los compuestos identificados que mejoren unos síntomas que reproducen los de la enfermedad humana. Por otro, la administración de este compuesto debe ser compatible con la vida de un organismo que, a efectos genéticos, es una versión simplificada de un genoma humano. En la mayoría de los casos, compuestos biológicamente activos identificados en Drosophila funcionan a su vez de manera similar en las células de mamíferos. Una spin-off de nuestro grupo de investigación, Valentia Biopharma, ha asumido el reto de descubrir fármacos potencialmente terapéuticos utilizando esta estrategia. BIBLIOGRAFÍA Begoña Cabia Fernández. Becaria predoctoral. Laboratorio de Endocrinología Molecular y Celular. Instituto de Investigaciones Sanitarias. Complejo Hospitalario Universitario de Santiago de Compostela (CHUS). |
© Mètode Drosophila es utilizada en investigaciones relacionadas con enfermedades humanas como la distrofia miotónica. De izquierda a derecha, podemos ver el ojo de una mosca sana, y a la derecha, el de una mosca modelo de distrofia miotónica, donde se pueden ver los defectos en el desarrollo del ojo. Esta enfermedad también impide a las moscas plegar las alas por problemas en la musculatura del vuelo (la mosca de la izquierda está sana y la de la derecha es la mosca modelo de distrofia miotónica). «Biológicamente, la arquitectura del sistema nervioso de Drosophila se asemeja a la de mamíferos, con áreas que separan funciones especializadas como la visión, aprendizaje y memoria» |
|