|
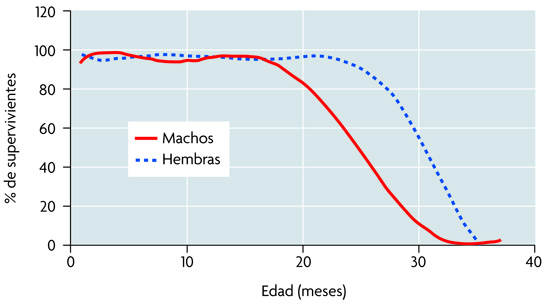
Sex and Longevity: Why Women Live Longer than Men. Mitochondria are a major source of free radicals in cells. In female rats, they generate half as much peroxide as those in male rats. This does not occur in ovariectomized animals. Estrogen replacement therapy prevents the fall in glutathione levels which occurs in ovariectomized animals. This is due to females behave as double transgenic over expressing antioxidant enzymes. Moreover, 16S rRNA expression, which decreases significantly with aging, is four times higher in mitochondria in females than in males of the same chronological age. These facts provide molecular evidence to explain the different life span in males and females. Diferencia de longevidad entre machos y hembras Uno de los mayores logros del siglo XX es el aumento de la esperanza de vida en nuestra especie. En Europa, ésta se ha duplicado entre 1900 y 1992. En todos los casos la esperanza de vida de las mujeres supera a la de los hombres. Es más, el porcentaje de diferencia de longevidad entre ambos sexos es mayor en aquellas épocas en las que la mortalidad es debida fundamentalmente a enfermedades asociadas al envejecimiento. De hecho, en España en 1900, la esperanza de vida para los hombres era de 33,7 años y para las mujeres de 35,1, es decir, un 3,8% superior en las mujeres. En 1992, la esperanza de vida de los hombres era de 73,7 años, mientras que la de las mujeres era 83,8, lo cual supone un 9,9% más en las mujeres. La base de la diferencia de esperanza de vida entre hombres y mujeres está aún por esclarecer. Este fenómeno no es atribuible exclusivamente a diferencias sociológicas, puesto que también se produce en otras especies. En nuestro laboratorio, las ratas Wistar hembra muestran una vida media un 16% superior a la de los machos, a pesar de que ambos sexos están sometidos a las mismas condiciones de vida (figura 1).
Las diferencias de longevidad entre machos y hembras tienen una base biológica: los estrógenos suponen una ventaja para la supervivencia de las hembras, puesto que inducen la expresión de enzimas antioxidantes, y ello las protege frente al estrés oxidativo, y por tanto les confiere una mayor longevidad. Los estrógenos poseen un efecto cardioprotector, actúan como antioxidantes in vitro, y se ha postulado que podrían ser agentes protectores frente a la enfermedad de Alzheimer. Sin embargo, aunque existen muchos estudios sobre el papel de los estrógenos en la prevención de enfermedades relacionadas con el envejecimiento, su mecanismo de acción no ha sido investigado todavía. Estrés oxidativo mitocondrial en machos y hembras Existen muchas teorías sobre el envejecimiento. Una de las más relevantes es la teoría de los radicales libres propuesta por Harman en 1956 que afirma que éstos están implicados en el daño celular que acompaña al envejecimiento y a las enfermedades relacionadas con él. Esta teoría se apoya en los experimentos que muestran que la sobreexpresión de enzimas antioxidantes, catalasa y superóxido dismutasa, prolonga la vida de la mosca Drosophila melanogaster. Además, existe una relación entre la producción mitocondrial de peróxidos y la longevidad de los mamíferos. Las mitocondrias constituyen la fuente principal de radicales libres de las células y los daños producidos por los radicales libres durante el envejecimiento se centran fundamentalmente en los componentes mitocondriales. El estrés oxidativo mitocondrial en los machos es superior al de las hembras, la concentración de peróxido de hidrógeno en las mitocondrias hepáticas y cerebrales aisladas de machos es superior al existente en las de las hembras y los niveles de glutatión reducido, un antioxidante endógeno, son mayores en las mitocondrias de las hembras. Nuestro grupo ha demostrado que, como consecuencia de este mayor estrés oxidativo en los machos, su DNA mitocondrial está hasta cuatro veces más oxidado que el de las hembras y ello se asocia con una menor longevidad y también que la oxidación del glutatión mitocondrial durante el envejecimiento y la apoptosis (muerte celular programada) está precisamente relacionada con el daño oxidativo del DNA mitocondrial. La ovariectomía incrementa el estrés oxidativo en las hembras. la reposición hormonal con estrógenos previene este aumentO La extirpación quirúrgica de los ovarios en ratas conduce a un incremento de la producción de peróxidos por las mitocondrias hepáticas, hasta alcanzar los niveles producidos por las mitocondrias de los machos. El tratamiento de las ratas ovariectomizadas con estradiol, revierte los niveles de peróxidos a los producidos por las ratas no ovariectomizadas (figura 2).
Asimismo, los niveles de glutatión reducido en mitocondrias hepáticas disminuyen después de la ovariectomía, y regresan a los valores normales cuando se les administran estrógenos. Todo ello demuestra que los estrógenos disminuyen la producción mitocondrial de peróxido de hidrógeno y aumentan los niveles de glutatión reducido y por tanto representan un papel protector muy importante frente al daño oxidativo mitocondrial asociado al envejecimiento. Los estrógenos inducen la expresión de genes de longevidaD La dosis diaria de estrógenos recomendada en humanos es muy baja para que manifieste un efecto antioxidante directo. Por ello, nos planteamos que los estrógenos actuaran como antioxidantes de modo indirecto, por medio de la inducción de la expresión de enzimas antioxidantes y estudiamos las enzimas antioxidantes manganeso-superóxido dismutasa (Mn-SOD) y glutatión peroxidasa (GPx). La expresión génica y la actividad de estas enzimas son mayores en mitocondrias hepáticas de hembras que en las de los machos de la misma edad (figura 3), lo que puede explicar la menor tasa de producción de peróxidos. Orr y Sohal demostraron en 1994 que la sobreexpresión de SOD o catalasa solas no aumenta la vida media, pero sí que lo consigue la sobreexpresión de ambas enzimas conjuntamente.
Figura 3. Expresión y actividad de la glutatión peroxidasa (arriba) y la Mn-superóxido dismutasa (abajo) en hígado de ratas machos y hembras. La defensa antioxidante de las ratas hembra es superior a la de las ratas macho. Por tanto, la mayor longevidad de las hembras se puede explicar porque se comportan como dobles transgénicos, que sobreexpresan las enzimas antioxidantes glutatión peroxidasa y manganeso superóxido dismutasa. Además, la telomerasa, otro parámetro relacionado con la longevidad, es influida por los estrógenos, y las hembras poseen una actividad telomerasa superior a la de los machos. Parámetros de envejecimiento indican que las hembras poseen una edad biológica menor que los machos La expresión del gen 16S rRNA mitocondrial disminuye significativamente con la edad. Esta disminución se correlaciona con la curva de supervivencia de la mosca Drosophila. Además, el estrés oxidativo también causa la disminución de la expresión del 16S rRNA y la expresión de este marcador de envejecimiento está disminuida en los machos en comparación con las hembras, lo cual supone que, con una misma edad cronológica, las hembras poseen una edad biológica menor que los machos, es decir, las hembras son biológicamente más jóvenes que los machos. Los fitoestrógenos como antioxidantes La genisteína, el fitoestrógeno más abundante presente en la soja, mimetiza los efectos antioxidantes del estradiol. Por ello se emplea en el tratamiento de varios síntomas asociados a la menopausia. Estudios en curso en nuestro laboratorio demuestran que los fitoestrógenos poseen muchas de las propiedades beneficiosas de los estrógenos, en lo que se refiere a su capacidad para inducir genes de longevidad. Ello abre una interesante posibilidad de utilizar estos compuestos, en lugar de los estrógenos, para intentar paliar efectos desagradables asociados al envejecimiento. Bibliografía Consuelo Borrás Blasco. Departament de Fisiologia, Facultat de Medicina i Odontologia, Universitat de València. |
«Los estrógenos representan un papel protector muy importante contra el daño oxidativo mitocondrial asociado al envejecimiento»
Foto: M. Lorenzo
«Con una misma edad cronológica las hembras son biológicamente más jóvenes que los machos» |









