Microalgas tóxicas y cambio global
¿Por qué se han incrementado las proliferaciones en el litoral mediterráneo?
El océano y el continente confluyen en una línea muy estrecha pero de una gran relevancia para la salud, el ocio y la economía de nuestra sociedad. La costa mediterránea ha experimentado un gran cambio durante los últimos cincuenta años que se pone de manifiesto en una alteración en las especies de microalgas que viven en ella. Ahora las proliferaciones de dinoflagelados son un componente habitual de las comunidades de organismos microscópicos de este ecosistema modificado por los seres humanos y por el cambio climático. El incremento en la frecuencia de detección de proliferaciones de microalgas tóxicas ha sido clave para tomar conciencia de este cambio.
Palabras clave: fitoplancton, fitobentos, microalgas, toxinas marinas, Ostreopsis.
Microalgas marinas y movilidad en un mundo globalizado
En un planeta globalizado y altamente comunicado como es este en el que vivimos, el desplazamiento humano desde una punta del mundo a la otra se realiza en pocas horas. Las mercancías, a pesar de que suelen tardar algo más, en cuestión de días, semanas o meses acaban en lugares muy alejados de donde fueron embarcadas. En este vaivén de personas y mercancías, a menudo transportamos, de manera accidental e involuntaria, algunos organismos vivos, tanto los que podemos ver a primera vista como los microscópicos (Hallegraeff, 1998). En este artículo nos centraremos en mostrar cómo microorganismos marinos, concretamente las microalgas, están modificando su distribución geográfica, a menudo expandiéndose hacia latitudes más altas, y reflexionaremos sobre su relación con el calentamiento global y con las actividades humanas.
«El impacto humano se traduce en incrementos en la cantidad y calidad de nutrientes vertidos a los ríos y al mar»
El problema se hace más aparente cuando algunas de estas especies producen toxinas que pueden afectar a la salud humana o al ecosistema marino. En el ecosistema terrestre, la pandemia de COVID-19 que estamos viviendo actualmente es un buen ejemplo de dispersión rápida de un patógeno a partir de un foco alejado de los muchos lugares a los que ha llegado a afectar. Esta redistribución de organismos es un hecho habitual en un planeta globalizado. Sin embargo, la problemática tan solo se pone de manifiesto cuando se expanden especies que tienen repercusiones negativas en la salud de las personas, el ecosistema o la economía.
Volviendo al ecosistema acuático, las microalgas son los principales productores primarios del océano. Las más conocidas forman parte del fitoplancton, que, como su nombre indica1, son el conjunto de organismos fotosintéticos que no tienen la capacidad de movimiento suficiente para superar la energía física del mar y, por tanto, son arrastrados por las corrientes marinas y las olas. Tapizando el fondo marino, o más globalmente, próximo, sobre o entre los granos de arena, encontramos el fitobentos.2 Las microalgas marinas, sean planctónicas o bentónicas, están experimentando en las últimas décadas una redistribución geográfica de sus especies. Nos centraremos en el caso del Mediterráneo, ese mar semicerrado rodeado por tierras densamente pobladas, globalmente considerado oligotrófico y con un escaso forzamiento de marea.
Presiones humanas sobre la costa y proliferaciones de dinoflagelados
La dinámica estacional del fitoplancton en las latitudes templadas presenta un periodo óptimo, a finales de invierno y principios de primavera, en que las microalgas proliferan y logran abundancias elevadas. Con la agitación invernal de la columna de agua ascienden nutrientes de las aguas profundas a las capas superficiales y, coincidiendo con el incremento de luz y temperatura, se produce un crecimiento de las comunidades de microalgas, principalmente diatomeas. Durante la primavera, las diferentes comunidades planctónicas se van sucediendo y consumiendo los nutrientes de las capas superficiales hasta casi agotarlos. El sol calienta la superficie del mar y se forma la termoclina, una estructura de densidad que separa las capas superficiales de las más profundas. Esta barrera física no permite la llegada de más nutrientes del fondo. Por eso, durante el verano, encontramos una baja abundancia de microalgas planctónicas en las aguas mediterráneas superficiales, hecho que las hace claras y transparentes. En otoño se produce otro pico de producción, más moderado, cuando vuelve a coincidir un nivel elevado de irradiancia con un incremento de nutrientes originado por la rotura de la termoclina y la mezcla de la columna de agua.

Figura 1A: Ejemplos de transformaciones del litoral producto de la acción humana. Urbanización de Empuriabrava (Castelló d’Empúries, Girona), construida en primera línea de mar en una zona de humedales. Las zonas húmedas costeras han sido prácticamente borradas del ecosistema litoral mediterráneo. / Foto: Jordi Camp
La presión que ejercemos los humanos sobre la costa es relevante. Y en un mar semicerrado y tan poblado como el Mediterráneo, el efecto humano es todavía más notable. El turismo hace que, durante los meses de verano, algunas poblaciones costeras multipliquen su población entre diez y cien veces. El impacto humano se traduce en incrementos en la cantidad y calidad de nutrientes vertidos a los ríos y al mar que no siempre pueden ser del todo eliminados por los sistemas de saneamiento. De este modo, la presión humana del continente sobre la franja litoral provoca un enriquecimiento de las aguas costeras. Los organismos fotosintéticos (productores primarios) utilizan estos nutrientes de origen antrópico y crecen.
La urbanización de la zona costera ha producido una impermeabilización del suelo (Figura 1A). Las zonas de humedales han sido prácticamente borradas del ecosistema litoral, han sido pavimentadas, y lo que en décadas pasadas actuaba como un filtro natural de las aguas ricas en nutrientes que aporta el continente, ahora son calles y ramblas pavimentadas que no filtran, sino que arrojan al mar costero todo lo que les llega (Camp et al., 1998). Son meras canalizaciones de agua enriquecida que hacen que el agua del mar, en primera línea de costa, se enriquezca de nutrientes. Los productores primarios utilizan estos nutrientes y crecen.
«Al confinar las aguas marinas costeras en puertos, hemos creado unas condiciones óptimas para el crecimiento de microalgas formadoras de “mareas rojas”»
La cimentación o rigidez de la costa también tiene un efecto importante en el mar. Por un lado, la construcción de embalses en los cauces fluviales ha reducido muy significativamente la aportación continua de sedimentos a la zona costera, sedimentos que, años atrás, eran transportados por corrientes costeras y distribuidos a lo largo de la costa de forma que abastecían de arena las playas. En las playas urbanas también se ha roto el ritmo de la naturaleza, ya que los sistemas de dunas y lagunas costeras han sido sustituidos por paseos marítimos y edificios junto a la playa. Los temporales de invierno que se llevan la arena de las playas dejan una playa erosionada, que no puede ser restablecida con la arena del sistema dunar porque este no existe, ni por los sedimentos que transportan los ríos porque se han visto muy reducidos. Parte de la arena que se ha llevado el mar queda acumulada en los espigones, que, construidos perpendicularmente a la línea de costa, cortan la circulación costera.
Así pues, hay que hacer grandes movimientos de arenas para recuperar unas playas que de otra manera se recuperarían solas. Así, año tras año, los gobiernos destinan una parte de los presupuestos para llevar a cabo varios proyectos de regeneración de playas. Se trata de actuaciones costosas tanto desde el punto de vista económico como del ecológico, que resultan efímeras, hasta la llegada del próximo temporal. La previsión en un escenario de cambio climático es que estos sean más frecuentes e intensos, tal y como nos hizo recordar a comienzos de 2020 el temporal Gloria.

Figura 1B): Puerto y playa de Cambrils, en Tarragona. La construcción de puertos y espigones incrementa el volumen de aguas confinadas, que son un hábitat idóneo para las proliferaciones de dinoflagelados. / Foto: Jordi Camp
Los puertos y espigones (Figura 1B), sin embargo, juegan otro papel. Al confinar las aguas para dar abrigo a las embarcaciones, se incrementa el tiempo de residencia de las aguas que albergan y favorecen el crecimiento y acumulación de microalgas. Aguas tranquilas, poco profundas, ricas en nutrientes y con un tiempo de residencia elevado son condiciones idóneas para el crecimiento de los dinoflagelados, un grupo de organismos del fitoplancton que produce proliferaciones y cambios de color, conocidas popularmente como mareas rojas y científicamente llamadas proliferaciones de algas nocivas. Por otro lado, los dinoflagelados son el grupo de organismos del fitoplancton que tienen más representantes de especies nocivas o tóxicas.
«Hace treinta años, Ostreopsis era un género raro en el Mediterráneo, detectado muy esporádicamente y en escasas abundancias»
Según el mandala del ecólogo Ramon Margalef (Margalef, 1978; Margalef, Estrada y Blasco, 1979; Figura 2), los dinoflagelados formadores de mareas rojas proliferan cuando coinciden elevados nutrientes y baja agitación del agua. Tal y como hemos explicado más arriba, las entradas de nutrientes suelen estar relacionadas con la agitación y mezcla de la columna de agua que aflora los nutrientes del fondo; por lo tanto, es poco habitual que los nutrientes elevados estén asociados a aguas tranquilas. Estas circunstancias se dan, de manera natural, en bahías o cerca de desembocaduras de ríos. Pero los humanos, confinando las aguas marinas costeras en puertos, hemos creado unas condiciones óptimas para el crecimiento de estas microalgas formadoras de mareas rojas. El hecho es que, cuando se implementaron los programas de monitorización de especies tóxicas en el Mediterráneo en los años noventa, nos encontramos que los dinoflagelados formadores de proliferaciones estaban muy bien representados. Esto no dejó de sorprendernos porque, según Margalef, el Mediterráneo no tenía las características apropiadas para que pudieran tener lugar las mareas rojas.
Nuestra hipótesis (Vila, Garcés, Masó y Camp, 2001) fue que el uso recreativo de la costa favorece las proliferaciones de dinoflagelados; la construcción de puertos –actualmente hay unos cincuenta a lo largo de la costa catalana, es decir, encontramos un puerto cada 8-10 km lineal de costa– genera cuerpos de agua semicerrados con notables concentraciones de nutrientes, tiempos de residencia del agua elevados (unos veinte días), baja turbulencia y baja advección en comparación con aguas no confinadas que favorecen estas proliferaciones.
Los dinoflagelados tienen estrategias de comportamiento (natación, migración vertical activa y agregación) y producen compuestos tóxicos, ambos aspectos implicados en reducir la depredación por parte del zooplancton (véase Selander et al., 2015; Smayda, 1997). Adicionalmente, las concentraciones de nutrientes inorgánicos y sus relaciones estequiométricas indican que las zonas caracterizadas por una elevada densidad humana tienen niveles más elevados de amonio y fosfatos y más limitación de silicatos. Por lo tanto, favorecen el crecimiento de los dinoflagelados, en relación con las diatomeas, que necesitan el silicato para construir sus cubiertas (frústulas) celulares.
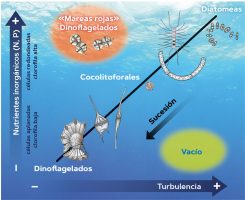
Figura 2. El mandala de Ramon Margalef es una representación esquemática que expone cómo la sucesión estacional de los principales grupos de fitoplancton depende de la concentración de nutrientes y la turbulencia o agitación del agua. / Fuente: Adaptación visual del mandala de Margalef (1978)
Finalmente, los puertos son entornos ideales donde los organismos que tienen formas de resistencia (quistes o semillas) pueden permanecer confinados en el sedimento hasta que las condiciones medioambientales los induzcan a germinar (Anderson y Wall, 1978). La tasa de crecimiento activa de una pequeña parte de la población que germina se ve amplificada por el comportamiento de natación y agregación, por la reducción de la depredación por parte del zooplancton y por los factores físicos favorables indicados anteriormente que propician las proliferaciones de dinoflagelados en los puertos. Por lo tanto, una costa con muchos puertos facilita la colonización y el establecimiento de las nuevas especies, alóctonas, que llegan. Este es el caso, concretamente, de las especies del género Alexandrium (Vila et al., 2001), algunas de las cuales son productoras de toxinas (saxitoxinas) que producen sintomatologías paralizantes en personas que han ingerido moluscos bivalvos contaminados con estos organismos (Berdalet et al., 2016).
Playas tapizadas por microalgas
Hace unos 20 o 25 años se empezaron a detectar proliferaciones de unos dinoflagelados bentónicos del género Ostreopsis en diferentes playas mediterráneas durante los meses de verano. En aquel momento, este género era conocido en áreas tropicales por formar parte del grupo de microorganismos (microbiota) acompañante de un dinoflagelado tóxico del género Gambierdiscus, causante de una intoxicación alimentaría tropical conocida como ciguatera (Friedman et al., 2017). El incremento de temperatura del agua del mar parece ser el factor desencadenante del establecimiento de varias especies tropicales en el Mediterráneo, que en determinados casos sustituyen a las comunidades nativas. Es lo que se conoce como tropicalización del Mediterráneo (Bianchi, Caroli, Guidetti y Morri, 2018).

Figura 3 (De izquierda a derecha). Hasta hace unos años, no era habitual encontrar dinoflagelados bentónicos del género Ostreopsis, más propios de zonas tropicales, en las aguas del Mediterráneo. El aumento de la temperatura del mar parece ser el factor desencadenante para que estas especies se estén estableciendo en él. En las imágenes: A) Coloración del agua durante una proliferación del dinoflagelado bentónico Ostreopsis. / Foto: Elisa Berdalet. B) Aspecto del fondo marino de una playa poco profunda tapizado por una proliferación de Ostreopsis. / Foto: Magda Vila.
Ostreopsis secreta una sustancia mucosa y pegajosa que la mantiene anclada, de forma laxa, a las macroalgas (Figura 3). Esta habilidad le permite mantenerse en la playa, cerca de la superficie y proliferar de manera relativamente rápida, formando un denso tapiz de microalgas y mucílago que recubre el fondo marino. Debido a la agitación del oleaje o a otros factores, Ostreopsis se desprende de la macroalga y se encuentra nadando por la columna de agua o flotando en superficie, y de este modo se forma lo que los franceses denominan flores de agua. Estas proliferaciones se han relacionado con mortalidades masivas de fauna marina con poca o nula movilidad (erizos, mejillones), quizás debidas a la limitación de oxígeno asociada a la gran capa mucilaginosa que puede llegar a recubrir el lecho marino, o bien a la producción de ciertas sustancias tóxicas (Giussani et al., 2016; Shears y Ross, 2009). Efectivamente, Ostreopsis produce ovatoxinas que son análogos de la palitoxina.
La palitoxina se ha relacionado con casos letales de intoxicación alimentaria en el océano Índico en personas que habían consumido alimentos marinos contaminados con estos compuestos. Estas toxinas entran en la red trófica cuando la fauna se alimenta de macroalgas recubiertas por Ostreopsis, y se transmiten hasta niveles tróficos superiores, incluídos los seres humanos (Berdalet et al., 2017). En el Mediterráneo, determinadas toxinas asociadas a Ostreopsis se han detectado en fauna marina diversa; sin embargo, no parece que la intoxicación alimentaria sea, hasta este momento, un problema en el Mediterráneo. En cambio, las proliferaciones masivas de Ostreopsis en esta área se han asociado con irritaciones respiratorias leves (rinorrea, fiebre, malestar general, irritación de los ojos y de la nariz, etc.) en bañistas y personas expuestas al aerosol marino en varias playas de Argelia, España, Francia, Italia y Grecia (Vila, Abós-Herràez, Isern-Fontanet, Àlvarez y Berdalet, 2016).
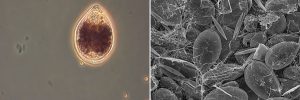
Figura 3 (De izquierda a derecha): C) Célula de Ostreopsis en el microscopio óptico./ Foto: Magda Vila. D) Aspecto de una proliferación bentónica dominada por Ostreopsis en el microscopio electrónico de rastreo. Se observa la red de filamentos que las células secretan. / Foto: Magda Vila i José Manuel Fortuñó
Un mecanismo similar, la exposición a aerosoles, se ha confirmado como causa de síntomas de irritación respiratoria durante la proliferación de Karenia brevis en el golfo de México (Fleming et al., 2011). En este caso, la enorme inversión científica hecha durante décadas de estudios entre varias instituciones ha proporcionado un conocimiento sólido que ya se ha materializado en la adecuada gestión de los riesgos ecológicos y para la salud en el golfo de México. Aun así, en el Mediterráneo, si bien estos síntomas se han intentado relacionar con la presencia de toxinas en el aerosol, los esfuerzos encaminados a la demostración empírica han dado escasas evidencias (Ciminiello et al., 2014).
Se ha planteado la hipótesis de que la irritación no fuera causada por las propias toxinas sino por algún otro componente o fragmento de la célula que desencadenara algún tipo de reacción, o incluso se ha especulado que pudiera estar producido por alguno de los microorganismos (bacterias o virus) asociados a Ostreopsis (Bellés-Garulera et al., 2016; Casabianca et al., 2013). Por otro lado, los bañistas que tienen heridas en la piel han sufrido también irritaciones cutáneas que se han resuelto con la aplicación de antibióticos tópicos. Todo ello hace pensar que hay más de un factor que contribuye a los diferentes efectos indeseables de las proliferaciones de Ostreopsis.
Reflexiones finales
Es evidente que la costa mediterránea ha cambiado mucho en los últimos cincuenta años. Un hábitat natural de playas y acantilados ha sido sustituido por un hábitat artificial de puertos y espigones, que han confinado no solo embarcaciones, sino también aguas y microalgas. Y un cambio de hábitat representa un cambio de especies. Los humedales han sido reducidos a la mínima expresión y se han multiplicado las urbanizaciones a primera línea de costa, lo que ha modificado en gran medida los flujos de sedimentos y nutrientes al mar. Finalmente, con el calentamiento global, se ha incrementado la temperatura del mar, y han llegado y se han establecido algunas especies invasoras. Por tanto, las comunidades de especies de microalgas que había hace cincuenta años han sido modificadas o bien se han «enriquecido», en algún caso, por proliferaciones de dinoflagelados tóxicos.
«El océano y el continente confluyen en una línea muy estrecha pero de una gran relevancia para la salud, el ocio y la economía de nuestra sociedad»
Actualmente, las proliferaciones planctónicas del género Alexandrium son recurrentes en el Mediterráneo y, desde los años noventa, se controlan semanalmente con programas de monitorización que garantizan la seguridad alimentaria de los productos que llegan a las lonjas y a las pescaderías. En cuanto al bentos, la evolución ha sido más lenta, por el gran desconocimiento que había sobre Ostreopsis años atrás. Hace treinta años, este organismo era un género raro en el Mediterráneo, detectado muy esporádicamente y en escasas abundancias. Ahora se ha convertido en un problema de salud pública y ambiental, que cada año moviliza a científicos y administraciones y que preocupa a los vecinos de las playas afectadas por estas proliferaciones masivas. Si nos centramos en los países de los que se dispone de más información (Mangialajo et al., 2011), lo que empezó siendo una proliferación masiva en alguna playa concreta durante los primeros años, se ha expandido a múltiples focos que afectan a muchas playas, primero de Italia y Francia y, desde hace cinco años, de Cataluña. Quedan muchas lagunas en cuanto a nuestra comprensión sobre la toxicidad de Ostreopsis. Sin embargo, el conocimiento de la dinámica de sus proliferaciones y la coordinación entre científicos y gestores medioambientales y de la salud ha permitido gestionar de manera adecuada el fenómeno y minimizar los riesgos ecológicos y para la salud.
Durante el último medio siglo hemos transformado el litoral con acciones directas sobre la costa como son la construcción de puertos y espigones, pero también en tierra firme, con la construcción de paseos marítimos y urbanizaciones en primera línea de costa, canalizaciones de los cauces de los ríos, y la construcción de embalses. Como resultado de la actividad humana también se ha incrementado el CO2 atmosférico y la temperatura global del planeta. Estas acciones humanas, directas o indirectas, son una respuesta plausible al porqué en las últimas décadas se han incrementado las proliferaciones de microalgas en las costas mediterráneas.
El océano y el continente confluyen en una línea muy estrecha pero de una gran relevancia para la salud, el ocio y la economía de nuestra sociedad. Mantener un litoral en un buen estado ecológico solo se podrá conseguir si la actividad que se realiza en el continente también mantiene los estándares de sostenibilidad. Para tener un litoral en buen estado, hay que repensar el mundo donde queremos vivir y actuar en consecuencia.
Notes
1. Plancton viene de la palabra griega πλαγκτός y significa «vagabundo». (Volver al texto)
2. Benthos, βένθος, significa «profundidad del mar». (Volver al texto)
Referencias
Anderson, D. M., & Wall, D. (1978). Potential importance of benthic cysts of Gonyaulax tamarensis and G. excavata in initiating toxic dinoflagellate blooms. Journal of Phycology, 14(2), 224–234. https://doi.org/10.1111/j.1529-8817.1978.tb02452.x
Bellés-Garulera, J., Vila, M., Borrull, E., Riobó, P., Franco, J. M., & Sala, M. M. (2016). Variability of planktonic and epiphytic vibrios in a coastal environment affected by Ostreopsis blooms. Scientia Marina, 80(S1), 97–106. https://doi.org/10.3989/scimar.04405.01A
Berdalet, E., Fleming, L. E., Gowen, R., Davidson, K., Hess, P., Backer, L. C., ... Enevoldsen, H. (2016). Marine harmful algal blooms, human health and wellbeing: Challenges and opportunities in the 21st century. Journal of the Marine Biological Association of the United Kingdom, 96(1), 61–91. https://doi.org/10.1017/S0025315415001733
Berdalet, E., Tester, P. A., Chinain, M., Fraga, S., Lemée, R., Litaker, W., ... Zingone, A. (2017). Harmful algal blooms in benthic systems: Recent progresses and future research. GEOHAB Oceanography (special issue), 30(1), 36–45. https://doi.org/10.5670/oceanog.2017.108
Bianchi, C. N., Caroli, F., Guidetti, P., & Morri, C. (2018). Seawater warming at the northern reach for southern species: Gulf of Genoa, NW Mediterranean. Journal of the Marine Biological Association of the United Kingdom, 98(1), 1–12. https://doi.org/10.1017/S0025315417000819
Camp, J., Masó, M., Vila, M., Delgado, M., Garcés, E., & Torres, M. (1998). Características ambientales del litoral Mediterráneo Noroccidental; situación actual e implicaciones: El caso de Cataluña. En Actas de la V Reunión Ibérica de Fitoplancton Tóxico. Vigo: ANFACO-CECOPESCA.
Casabianca, S., Casabianca, A., Riobó, P., Franco, J. M., Vila, M., & Penna, A. (2013). Quantification of the toxic dinoflagellate Ostreopsis spp. by qPCR assay in marine aerosol. Environmental Science & Technology, 47(8), 3788−3795. https://doi.org/10.1021/es305018s
Ciminiello, P., Dell’Aversano, C., Dello Iacovo, E., Fattorusso, E., Forino, M., Tartaglione, L., … Penna, A. (2014). First finding of Ostreopsis cf. ovata toxins in marine aerosols. Environmental Science & Technology, 48(6), 3532–3540. https://doi.org/10.1021/es405617d
Fleming, L. E., Kirkpatrick, B., Backer, L. C., Walsh, C. J., Nierenberg, K., Clark, J., ... Baden, D. G. (2011). Review of Florida red tide and human health effects. Harmful Algae, 10(2), 224–233. https://doi.org/10.1016/j.hal.2010.08.006
Friedman, M. A., Fernandez, M., Backer, L. C., Dickey, R., Bernstein, J., Schrank, K., ... Fleming, L. E. (2017). An updated review of ciguatera fish poisoning: Clinical, epidemiological, environmental, and public health management. Marine Drugs, 15(3), 72. https://doi.org/10.3390/md15030072
Giussani, V., Costa, E., Pecorino, D., Berdalet, E., De Giampaulis, G., Gentile, M., ... Faimali, M. (2016). Effects of the harmful dinoflagellate Ostreopsis cf. ovata on different life cycle stages of the common moon jellyfish Aurelia sp. Harmful Algae, 57, 49–58. https://doi.org/10.1016/j.hal.2016.05.005
Hallegraeff, G. M. (1998). Transport of toxic dinoflagellates via ships’ ballast water: Bioeconomic risk assessment and efficacy of possible ballast water management strategies. Marine Ecology Progress Series, 168, 297–309. https://doi.org/10.3354/MEPS168297
Mangialajo, L., Ganzin, N., Accoroni, S., Asnaghi, V., Blanfuné, A., Cabrini, M., ... Lemée, R. (2011). Trends in Ostreopsis proliferation along the Northern Mediterranean coasts. Toxicon, 57(3), 408–420. https://doi.org/10.1016/j.toxicon.2010.11.019
Margalef, R. (1978). Life-forms of phytoplankton as survival alternatives in an unstable environment. Oceanologica Acta, 1(4), 493–509.
Margalef, R., Estrada, M., & Blasco, D. (1979). Functional morphology of organisms involved in red tides, as adapted to decaying turbulence. En D. L. Taylor, & H. H. Seliger (Eds.), Toxic dinoflagellate blooms (pp. 89–94). Amsterdam: Elsevier.
Selander, E., Kubanek, J., Hamberg, M., Andersson, M. X., Cervin, G., & Pavia, H. (2015). Predator lipids induce paralytic shellfish toxins in bloom-forming algae. Proceedings of the National Academy of Sciences of the United States of America, 112(20), 6395–6400. https://doi.org/10.1073/pnas.1420154112
Shears, N. T., & Ross, P. M. (2009). Blooms of benthic dinoflagellates of the genus Ostreopsis: An increasing and ecologically important phenomenon on temperate reefs in New Zealand and worldwide. Harmful Algae, 8(6), 916–925. https://doi.org/10.1016/j.hal.2009.05.003
Smayda, T. J. (1997). Harmful algal blooms: Their ecophysiology and general relevance to phytoplankton blooms in the sea. Limnology and Oceanography, 42(5, Part 2), 1137–1153. https://doi.org/10.4319/lo.1997.42.5_part_2.1137
Vila, M., Abós-Herràndiz, R., Isern-Fontanet, J., Àlvarez, J., & Berdalet, E. (2016). Establishing the link between Ostreopsis cf. ovata blooms and human health impacts using ecology and epidemiology. Scientia Marina, 80(S1), 107–115. https://doi.org/10.3989/scimar.04395.08A
Vila, M., Garcés, E., Masó, M., & Camp, J. (2001). Is the distribution of the toxic dinoflagellate Alexandrium catenella expanding along the NW Mediterranean coast? Marine Ecology Progress Series, 222, 73–83. https://doi.org/10.3354/meps222073





