{rokbox text=| |}images/stories/numeros/METODE_57/118b-57.jpg{/rokbox} |}images/stories/numeros/METODE_57/118b-57.jpg{/rokbox}Hagan clic en la imagen para verla con más detalle. |
|
|
|
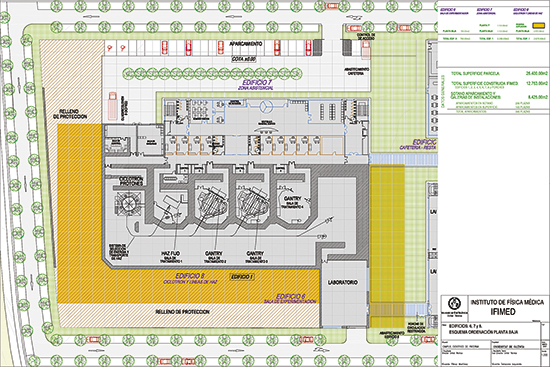
Small Accelerators for Medical Application. Los aceleradores de partículas fueron principalmente concebidos, diseñados y utilizados para la investigación en física nuclear y física de altas energías. Pero, en la actualidad, se utilizan cada vez más en campos tan diversos como la ciencia de materiales, la biología, la medicina o la arqueología. En el mundo hay más de 8.000 pequeños aceleradores de bajas energías (hasta unos pocos MeV por unidad de masa para iones ligeros) dedicados a implantación de iones, espectroscopia de masas, emisión de rayos X inducidos por protones (PIXE), etc. Hay unos 250 ciclotrones dedicados a la producción de isótopos, tanto para tratamientos tumorales como para su uso en la tomografía por emisión de positrones. En su mayoría aceleran protones o deuterios hasta 30 MeV de energía. Hay también unos 10.000 aceleradores lineales de electrones (linacs) que producen fotones de alta energía para radioterapia. Existen cerca de 30 aceleradores, entre instalaciones de investigación y hospitalarias, que funcionan por encima de 60 MeV, para radioterapia con iones, pues permiten una precisa adaptación al tumor de la radiación al maximizar el control del mismo y reducir, al mismo tiempo, el riesgo de efectos secundarios. Todos estos pequeños aceleradores han utilizado y siguen utilizando la I+D surgida de la construcción de grandes aceleradores, cuyo objetivo principal es el estudio de la estructura de la materia con energías y resoluciones cada vez mayores. En este artículo describiremos los principales aspectos de un tipo de estos pequeños aceleradores dedicados a la hadronterapia, es decir, a acelerar protones e iones ligeros para el tratamiento de tumores. Los primeros aceleradores En 1945 W. Hansen construyó en la Universidad de Stanford un acelerador lineal de apenas 1 m de longitud, que aceleraba electrones a 4,5 MeV. Funcionaba a una frecuencia de 3 GHz, previamente inimaginable, lo que fue posible gracias al klystron pulsado de alta potencia, inventado por los hermanos Varian y desarrollado para los radares usados en la Segunda Guerra Mundial. Hansen pensaba en impulsar la investigación en física nuclear, pero su invento tuvo un enorme impacto en medicina. El mismo año R. Wilson calculaba, por encargo de E. Lawrence, el espesor del blindaje necesario para un ciclotrón de 150 MeV que se iba a instalar en la Universidad de Harvard. El comportamiento de la radiación al atravesar unos pocos centímetros de plomo fue para él una gran sorpresa. El estrecho «pico de Bragg» al final del recorrido le llevó a sugerir, en un ahora famoso artículo, el uso de protones para irradiar tumores, ya que se preservarían así, mucho más que con rayos X, los tejidos sanos atravesados, contiguos y situados más profundamente. Sin embargo, el artículo tuvo poco impacto en la comunidad médica y hubo que esperar unos diez años antes de que se trataran los primeros pacientes, en Berkeley y en Harvard, con haces de protones producidos en aceleradores, dedicados en un principio a la física nuclear. Finalmente, en Loma Linda, centro médico universitario de California, se construyó el primer sincrotrón de protones dedicado íntegramente a la protonterapia. En 1993 se empezó a irradiar pacientes en tres salas. No es por casualidad que el ciclotrón de Loma Linda se construyera en Fermilab, el laboratorio de física de partículas que creó Wilson, y dirigió hasta 1987. La energía del acelerador está determinada por la profundidad de penetración en el cuerpo humano: con protones de 200 MeV se llega a unos 27 cm. Nuevos centros de tratamiento Desde 1993, unos 15.000 pacientes en todo el mundo han sido tratados con protones y, en este tiempo, se ha mostrado que tienen los mismos efectos biológicos y clínicos que los rayos X producidos por linacs de unos pocos MeV. A principios de 2007, se superó el hito de 50.000 pacientes, irradiados en doce laboratorios de física subatómica y en más de diez centros de protonterapia situados en hospitales. Diez centros más están en construcción o en proyecto en todo el mundo, pues ya hay cinco empresas que proporcionan estas instalaciones llaves en mano. Este número por sí sólo ya justifica la afirmación de que la protonterapia está en plena expansión. En estos centros de protonterapia se utiliza o un ciclotrón o un sincrotrón (de unos 5 o 7 m de diámetro respectivamente), ya que ambos aceleradores tienen la fiabilidad necesaria para funcionar en un entorno hospitalario. En la actualidad hay cinco centros en EE UU, cuatro en Japón, dos en China, uno en Suiza, uno en Alemania. Francia, Corea e Italia también disponen de un centro, bien ya en funcionamiento o bien financiado. En España hay un centro, el IFIMED (Instituto de Física Médica), que se prevé que entre en funcionamiento hacia el 2012. Veamos la estructura de uno de estos aceleradores. Hay dos componentes principales: el sistema de producción de iones y el sistema de distribución del haz. El primero produce el haz de protones y lo dirige a la sala apropiada, de tratamiento o de experimentación, mediante un sistema de transporte. Incluye el ciclotrón y los sistemas de selección de energía y de transporte del haz. El ciclotrón de protones tiene una energía fija de 230 MeV, y mediante un reductor variable de energía se obtiene la energía necesaria para cada tratamiento (de 230 a 70 MeV). En un sincrotrón no es necesaria esta operación, pues la energía del haz es variable. Un sistema de transporte conecta la zona de selección de energía con el punto de entrada de cada sala y permite proporcionar un haz centrado, con las propiedades adecuadas para la zona experimental o de tratamiento. |
«Existen cerca de 30 aceleradores que permiten una precisa adaptación al tumor de la radiación al maximizar el control de éste y reducir, al mismo tiempo, el riesgo de efectos secundarios» |
|

Acelerador lineal de electrones del Hospital Universitario La Fe (Valencia). Puede girar alrededor de la camilla, cuya posición se ajusta exactamente con un sistema de láseres (luces rojas). |
«El objetivo final de cualquier sistema de aplicación es producir un haz que abarque las dimensiones adecuadas para el tratamiento» |
|
|
El sistema de distribución, situado en cada sala de tratamiento, dirige el haz de protones al lugar donde se encuentra el paciente. Proporciona una distribución adecuada de dosis, tanto en sentido longitudinal como transversal. Contiene un gantry, que es una estructura de 10 m de altura capaz de girar ±190º alrededor del paciente y de tamaño adecuado para irradiar al paciente desde cualquier ángulo, aunque también hay salas de haz fijo a las que éste llega horizontalmente. En cualquier caso, hay dispositivos para variar la posición del paciente según seis grados de libertad, que alcanzan una precisión de ±0.5 mm. En la parte final del sistema de aplicación se sitúa un dispositivo con el equipo necesario para preparar y medir las propiedades del haz y suministrarlo de distintos modos: dispersión simple o doble, barrido uniforme o en pincel. El objetivo final de cualquier sistema de aplicación es producir un haz que abarque las dimensiones transversal y longitudinal adecuadas a cada tratamiento. Además, todo el conjunto dispone de un control global de seguridad, con dispositivos y programas redundantes para garantizar un alto nivel de seguridad, tanto para el paciente como para el personal clínico, científico o técnico. Casi al mismo tiempo en que empezaron a utilizarse protones en el tratamiento contra el cáncer, se inició el uso de iones pesados, es decir, átomos completamente ionizados. El interés de estos iones está en que, al tener mayor masa y carga que las del protón, pueden depositar una mayor energía por unidad de longitud de camino recorrido, o transferencia lineal de energía, lo que se traduce en una mayor eficiencia al final de la curva de Bragg. Es en efecto, la mayor ionización lo que produce una mayor efectividad. El principal objetivo del ataque con radiaciones es el DNA dentro del núcleo de las células, o más precisamente, su capacidad de reparación: las dosis locales muy altas producen un colapso de este sistema. La dosis concentrada es más efectiva en comparación con una radiación diseminada, y aumenta la eficacia biológica efectiva. Desde el 2000 han sido tratados con iones de carbono más de 350 pacientes en el proyecto piloto del laboratorio de física nuclear GSI, en Darmstadt, Alemania, y unos 3.500 pacientes han sido tratados desde 1994 en el acelerador médico de iones pesados de Chiba, Japón. Los resultados clínicos obtenidos en estos laboratorios confirman las predicciones radiobiológicas de que los iones de carbono tienen una eficacia biológica mayor que los protones, pues producen una ionización 24 veces superior. El tratamiento con iones de carbono es adecuado para tumores de crecimiento lento, que son resistentes a los protones y a los fotones. Pero el uso de iones de carbono presenta una complejidad mucho mayor que el uso de protones, no sólo en lo que se refiere al propio acelerador sino, especialmente, al sistema de aplicación y a los gantries. Mientras que con protones de 200 MeV se alcanzan tumores a 27 cm dentro del cuerpo, son necesarios iones de carbono de unos 4.800 MeV (400 MeV/u) para alcanzar esta profundidad. En los últimos cinco años se han dado en Europa pasos importantes hacia el desarrollo y construcción de centros duales, que puedan utilizar tanto protones como iones de carbono, basados en sincrotrones. Pero la compañía belga IBA está desarrollando un prototipo de un ciclotrón superconductor de 6 metros de diámetro capaz de acelerar iones de carbono hasta la energía requerida de 400 MeV/u. Los futuros desarrollos, la I+D más interesante capaz de introducir nuevas y más destacadas mejoras en el campo de la hadronterapia, están relacionados en sentido amplio con los avances en la tecnología de aceleradores. Ugo Amaldi. Università degli Studi di Milano – Bicocca y Fondazione TERA. |






