|
«Ja el nàixer és un gran plor», nos canta Raimon. Hay dos momentos cruciales que delimitan toda vida humana: el nacimiento y la muerte. La muerte llega de muchas formas, agónica o tranquila, sufriendo lentamente o por un gran trauma repentino, conscientes o sin que nos demos cuenta. El nacimiento, sin embargo, casi siempre va acompañado de un gran llanto; un llanto necesario para respirar de manera autónoma y consecuencia del choque que nos produce ser expulsados del confortable útero materno y encontrarnos en un ambiente hostil, seco y frío, que no abandonaremos hasta la muerte. Toda nuestra vida, y la muerte, está acompañada de microbios. De toda nuestra existencia, solo los primeros nueve meses (dentro del útero), o eso es lo que se pensaba hasta ahora, estamos aislados del contacto o la interacción con los microorganismos. Ya durante el parto, nuestra piel y el tubo digestivo empiezan a colonizarse. Al romperse el saco amniótico, desprenderse la placenta y pasar por la vagina de la madre, nuestra piel delicada se va «contaminando» de microbios. Inmediatamente después continuamos incorporando más microbios, esta vez ya dentro de la boca y el resto del tubo digestivo, debido al contacto con el cuerpo de la madre y con el ambiente. En el transcurso de un embarazo normal y saludable, el cuerpo de la madre experimenta cambios importantes anatómicos, fisiológicos y bioquímicos. Primero aumenta la grasa corporal; posteriormente, según avanza la gestación, hay una reducción de la sensibilidad a la insulina. Durante el embarazo se observan niveles elevados de citoquinas circulantes, es decir, un aumento del estado de inflamación y síndrome metabólico que conduce hacia una especie de «obesidad». Esta «obesidad» fisiológica y la pérdida de sensibilidad a la insulina son beneficiosas, ya que favorece el crecimiento del feto y prepara el cuerpo de la madre para la demanda energética de la lactancia. Durante el embarazo se produce un cambio en el sistema inmunitario de la madre para evitar el rechazo al feto (a nivel de placenta), sin embargo, por otra parte, aumenta la respuesta inflamatoria de las mucosas, lo que puede conducir, por ejemplo, a la gingivitis. La placenta permite pasar al feto el oxígeno y los nutrientes, y retirar los productos de desecho, sin que haya mezcla de la sangre materna y la fetal. La placenta, por tanto, interviene en la nutrición, el control del crecimiento y la regulación del metabolismo, haciendo las funciones de pulmones, intestino y riñones del feto, que solamente empezarán a trabajar de manera autónoma a partir del parto. Durante el embarazo se habían descrito cambios importantes en la microbiota de la madre, tanto del tracto intestinal como de la vagina. Pero ahora se está viendo que también experimentan modificaciones importantes la microbiota oral, la de la piel y la de la placenta. Estos cambios en la microbiota de la madre parecen cruciales para el futuro desarrollo de una microbiota «sana» del neonato. Durante el embarazo, la microbiota de la vagina disminuye en diversidad y dominan algunas especies de Lactobacillus, como L. crispatus, L. jensenii o L. johnsonii. El enriquecimiento de estas especies tiene significado biológico. Por ejemplo, L. jensenii metaboliza el glucógeno, que se incrementa con el aumento de los niveles de estrógeno, y que contribuye a la acidez vaginal. Además, L. jensenii puede presentar en la superficie celular proteínas que inhiben algunos patógenos que causan infecciones de transmisión sexual, como Neisseria gonorrhoeae. Finalmente, L. crispatus y L. jensenii producen peróxido de hidrógeno, que podría proteger contra algunas infecciones bacterianas de la vagina. Tras el parto, L. johnsonii coloniza el tracto intestinal del neonato y le ayuda a digerir la leche. |
«La placenta hace las funciones de pulmones, intestino y riñones del feto, que solamente empezarán a trabajar de manera autónoma a partir del parto» |
|
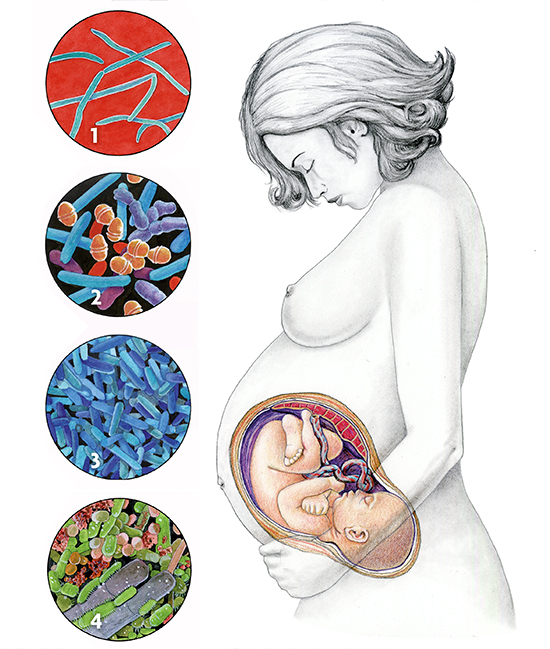
 Ilustración: Carles Puche Ilustración: Carles PucheMicrobiota de diferentes partes del cuerpo de una mujer. 1. Fusobacterium, en líquido amniótico (solo en situación patológica, en mujeres que sufren parto prematuro). 2. Microbiota normal de la placenta, representada por un bajo número de bacterias, pero pertenecientes a diferentes grupos (como los filos Firmicutes, Tenericutes, Proteobacteria, Bacteroidetes y Fusobacteria). 3. Microbiota de la vagina, donde normalmente predomina Lactobacillus acidophilus, pero durante el embarazo pasan a ser abundantes otras especies del mismo género, como L. crispatus, L. jensenii y L. johnsonii. 4. Microbiota de la piel correspondiente a una zona húmeda, como el pubis, donde predominan los filos Firmicutes y Actinobacteria. |
||
|
Siempre se había creído que la placenta no tenía ningún microbio, pero recientemente se ha observado que la placenta tiene algunos tipos de microorganismos, tanto gram-positivos como gram-negativos. Generalmente, estos microorganismos no son patógenos, sin embargo, en algunos casos, las variaciones en su composición podrían ser el origen de trastornos poco conocidos del embarazo, como el parto prematuro, que se produce en uno de cada diez embarazos. La inflamación de la placenta puede provocar contracciones y el parto prematuro. Estos resultados refuerzan observaciones previas que relacionaban las enfermedades periodontales de la madre con los partos prematuros. El tracto intestinal del feto se ha considerado que no tenía ningún microbio, pero parece que la exposición del feto a los microorganismos podría ser anterior al parto, por los microorganismos que colonizan la placenta. Lo que ya era conocido es que unos pocos microorganismos patógenos, como las bacterias Treponema pallidum (sífilis) o Listeria monocytogenes (listeriosis) y el virus VIH (sida), eran capaces de atravesar la barrera placentaria y penetrar en el cuerpo del feto a través de la sangre. Así, el recién nacido podría tener una infección congénita con graves secuelas y que incluso puede causar la muerte. La composición bacteriana del tracto intestinal de un recién nacido solamente una semana después de nacer es compleja, dinámica y fluctuante. Los niños no presentan una microbiota equilibrada similar a la de los adultos hasta alrededor del primer año. En la primera semana de vida, el intestino ya está colonizado por Actinobacteria (incluyendo Bifidobacterium), Proteobacteria, Bacteroides y, en menor proporción, Firmicutes (o gram-positivos, como Lactobacillus, que es el microorganismo dominante en la vagina). Por el contrario, en los neonatos prematuros con un peso inferior a 1.200 gramos dominan los Firmicutes y Tenericutes, y tienen menor proporción de Actinobacteria. Además del tipo de parto, la alimentación por lactancia materna o artificial tiene un gran impacto en la microbiota del recién nacido. La lactancia materna selecciona a aquellos organismos capaces de utilizar los constituyentes de la leche materna. Los oligosacáridos de la leche humana son los principales factores de crecimiento por Bifidobacterium, y también por los Bacteroidetes. Cuando consideramos la historia de la microbiología, podemos decir que ha tenido tres edades de oro. La primera, sin duda, es la que empezaron Pasteur y Koch, durante el último cuarto del siglo xix, y en la que se identificaron la mayor parte de las enfermedades infecciosas. La segunda correspondería a las décadas de los cuarenta y cincuenta del siglo xx, cuando el descubrimiento y aplicación de los antibióticos representó la primera arma efectiva contra las infecciones. Finalmente, la tercera ha sido la edad de la genómica, en las dos últimas décadas del siglo xx. Pero ya en el siglo xxi estamos entrando en una cuarta edad de oro, donde la secuenciación masiva de todos los microorganismos presentes en un determinado lugar (piel, boca, intestino, etc.), o metagenómica, ha permitido descubrir la presencia y posible función de microorganismos que ni tan siquiera se sospechaban. Se calcula que en una boca normal hay hasta setecientas especies de bacterias –aunque el concepto habitual de especie en animales y plantas es muy diferente de lo que se puede considerar «especie» en las bacterias. En los últimos años se han hecho grandes progresos no solo en la identificación, aislamiento y cultivo de los miembros de la microbiota intestinal, sino también en el desarrollo de herramientas y modelos genéticos que permiten estudiar la interacción entre el microbioma (o conjunto de genes de los microbios del cuerpo), y la genética y fisiología del huésped. La combinación de estas herramientas para realizar nuevos estudios en el futuro aumentará en gran medida, nuestra comprensión de las dianas moleculares en la interacción homeostática entre la microbiota intestinal y nuestro cuerpo, y, por tanto, promete revelar nuevas formas de tratar las enfermedades y mantener la salud. Ricard Guerrero. Miembro del Institut d’Estudis Catalans. |





