Construyendo cerebros capaces de evolucionar
Retos y perspectivas de la neurobiología evolutiva del desarrollo
La biología evolutiva del desarrollo (también conocida como evo-devo, del inglés evolutionary developmental biology) consiste en comparar las trayectorias de desarrollo completas de las especies, y no solo las formas adultas. Este enfoque ha demostrado tener éxito en lo referente a la morfología general, pero su aplicación para resolver problemas de neurobiología es todavía es bastante innovadora. Hasta la fecha, el campo donde la neurobiología evolutiva del desarrollo ha cosechado más éxitos ha sido en el uso de datos comparativos referidos al desarrollo para determinar las homologías adultas. La perspectiva más apasionante es el uso de estos datos para comprender cómo aparecen las diferencias en las estructuras y funciones adultas. En este sentido, un «sistema modelo» muy interesante es el estudio de por qué el neocórtex se pliega en algunas especies pero no en otras.
Palabras clave: cerebro, evolución, desarrollo, homología, plegamiento cortical.
Según me enseñaron, el truco para hacer ciencia de la buena es encontrar un conjunto de preguntas que sean a la vez interesantes y resolubles con los métodos actualmente disponibles (Medawar, 1967). Y también aprendí que este conjunto de preguntas tiende a cambiar con el tiempo, a medida que las preguntas más antiguas van encontrando respuesta o van perdiendo brillo y nuevos métodos dan pie a nuevas preguntas. Considerando estas lecciones, periódicamente hago balance de dónde viene mi campo de investigación y hacia dónde se dirige. Este ensayo refleja esos pensamientos, aunque esté escrito con una perspectiva más amplia y examine la situación actual y las expectativas de la neurobiología evolutiva del desarrollo, un campo que compagina el estudio de la evolución del cerebro con el del desarrollo de este mismo órgano.
La biología evolutiva del desarrollo dentro de la biología general
Durante buena parte del siglo xx, la biología evolutiva estuvo sometida a un punto de vista que básicamente olvidaba el desarrollo y que trataba el cambio evolutivo como si los adultos ancestrales se hubiesen transformado directamente en descendientes adultos. Por ejemplo, en los tan difundidos gráficos de la evolución del caballo se muestran los pequeños adultos ancestrales como versiones de formas adultas mucho más grandes. El hecho de que cada caballo adulto evolucionase desde un embrión y dejase descendencia que tuvo que crecer antes de alcanzar la edad adulta se consideraba en gran medida irrelevante para la historia evolutiva. A medida que avanzaba el siglo xx, los biólogos evolucionistas se fueron interesando cada vez más por el mecanismo que guía los cambios evolutivos subyacentes en la morfología adulta, pero se centraban casi exclusivamente en los cambios en las frecuencias génicas o alélicas e ignoraban casi siempre el papel de los genes en el desarrollo orgánico. Como escribió en 1951 Theodosius Dobzhansky, uno de los fundadores de la síntesis moderna de la biología evolutiva: «El estudio de los mecanismos de la evolución pertenece al ámbito de la genética de poblaciones» (citado en Gilbert, Opitz y Raff, 1996). Así pues, la síntesis moderna combinaba la genética de poblaciones con la morfología comparada clásica, pero hacía poco o ningún uso de la embriología.
«La síntesis moderna combinaba la genética de poblaciones con la morfología comparada clásica, pero hacía poco o ningún uso de la embriología»
Probablemente una razón de esta omisión fue que Ernst Haeckel y sus discípulos a finales del siglo xix cayeron en el error de simplificar excesivamente la relación entre el desarrollo (ontogénesis) y el cambio evolutivo (filogénesis). Argumentaban que, en la evolución de los organismos individuales, estos recorrían los estadios adultos de sus ancestros o, por decirlo en pocas palabras, que «la ontogénesis recapitula la filogénesis» (véase Gould, 1977). Desde este punto de vista, el desarrollo de los embriones de mamíferos pasa por etapas en las que tienen branquias, que se corresponderían con las branquias de los antiguos peces y anfibios a partir de los cuales evolucionaron los mamíferos. Para Haeckel, que los mamíferos adultos no conserven estas agallas se debe simplemente a que continúan desarrollándose hasta que las agallas se transforman en otras estructuras, como la mandíbula y los huesos del oído medio. En esencia, Haeckel y sus seguidores pensaban que el cambio evolutivo solamente se debía a la adición de nuevas etapas al final de la ontogénesis de un antepasado. Si eso fuera cierto, entonces el desarrollo embrionario de cada especie pasaría por las etapas adultas de sus ancestros siguiendo un orden cronológico.
En todo caso, el planteamiento de Haeckel era demasiado limitado. Una gran cantidad de datos embrionarios nos muestra ahora que las transformaciones evolutivas a veces implican la supresión de etapas ancestrales adultas (en ocasiones, este proceso se llama pedomorfosis) o, más frecuentemente, cambios a medio camino en el desarrollo, antes de que los ancestros alcancen el estadio adulto. El último punto de vista, que considera el desarrollo divergente entre especies, se remonta a Karl Ernst von Baer a mediados del siglo xix y por tanto es anterior al principal trabajo de Haeckel, pero tuvo una difusión lenta, tal vez porque Von Baer se había opuesto tenazmente a la teoría de la evolución de Darwin. En cualquier caso, siempre que la trayectoria de desarrollo de una especie descendiente acaba prematuramente o diverge de la del antecesor, el desarrollo individual no puede recapitular la filogenia (figura 1). En lugar de la ontogenia que recapitula la filogenia, el patrón más común es que las diferentes especies se parezcan entre sí bastante durante algunas etapas tempranas del desarrollo embrionario (a menudo llamado el estadio filotípico) y que después diverjan a medida que van creciendo. Así pues, los estados embrionarios de los mamíferos en realidad no presentan branquias sino que tienen hendiduras faríngeas que se parecen bastante a las de otros embriones de vertebrados. Cuando estas hendiduras faríngeas se desarrollan, igual que las barras que hay entre ellas, adoptan diferentes formas en distintos linajes de vertebrados.
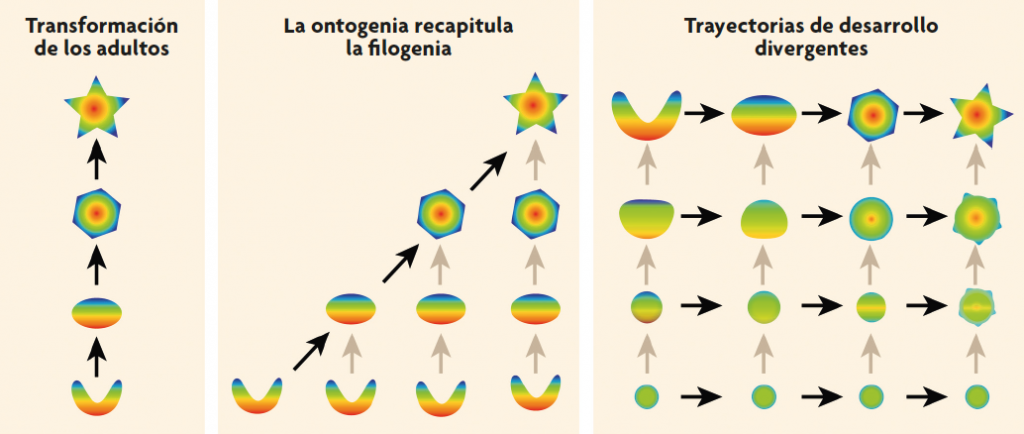
Figura 1. Cambios en los puntos de vista sobre la relación entre el desarrollo y el cambio evolutivo. La mayoría de la gente considera que el cambio evolutivo consiste en que los adultos ancestrales se transformaron directamente en sus descendientes adultos (izquierda). Ernst Haeckel y sus discípulos trataron de integrar la evolución y el desarrollo y proclamaron que «la ontogenia recapitula la filogenia», es decir, que las sucesivas etapas del desarrollo de un individuo corresponden a los estadios adultos de sucesivos antecesores (centro). Desde un punto de vista más moderno, el de la biología evolutiva del desarrollo, el cambio evolutivo implicaría cambios en cualquier paso a lo largo de una ontogenia ancestral, con trayectorias de desarrollo frecuentemente divergentes entre especies. Como resultado, los estadios tempranos del desarrollo suelen ser más similares entre las especies que los estadios más tardíos. Las flechas negras indican transformaciones entre formas adultas o de estadios similares; las flechas grises indican transformaciones de desarrollo. / Georg F. Striedter
Un segundo problema con la teoría de Haeckel era que consideraba el desarrollo como el mecanismo que dirige el cambio evolutivo. Este punto de vista es coherente con la idea de Haeckel de que los cambios en el desarrollo de un individuo se pueden transmitir a su descendencia (es decir, la herencia de los caracteres adquiridos), pero era difícil de integrar en la síntesis moderna de la biología evolutiva, ya que en esta síntesis las diferencias en el desarrollo se consideraban como el resultado de la evolución, no como la causa. Como hemos dicho, los creadores de la síntesis moderna consideraban los cambios en las frecuencias alélicas como el motor del cambio evolutivo; las relaciones causales entre los genes y el desarrollo continuaron en la oscuridad y cayeron en el olvido.
«La biología evolutiva del desarrollo se puede aplicar con provecho a la evolución de picos, extremidades, aletas y huesos, así que ¿por qué no probar si funciona con el cerebro?»
Esta situación cambió hacia finales del siglo xx, cuando la biología del desarrollo se orientó cada vez más hacia el ámbito molecular y se dedicó a explorar y manipular la expresión génica en embriones. Una vez que en este ámbito se empezaron a hacer comparaciones y se extendieron más allá de un selecto grupo de «especies modelo», fue posible estudiar los mecanismos moleculares subyacentes a la divergencia evolutiva en el desarrollo. Este trabajo permitió que la biología del desarrollo se fuese integrando en la biología evolutiva como complemento de la genética de poblaciones y que naciese la biología evolutiva del desarrollo (Gilbert et al., 1996). Este campo incipiente se expandió rápidamente y continúa floreciendo hoy en día, como muestran las revistas especializadas y los paneles de evaluación de proyectos de investigación.
También yo caí fascinado por la biología evolutiva del desarrollo en los ochenta. Me atraía la idea de introducirme en los mecanismos moleculares del cambio evolutivo y comparar la ontogenia de diferentes especies, identificar los cambios evolutivos específicos en las trayectorias de desarrollo, correlacionar todos esos cambios morfológicos con los cambios en la expresión génica y, finalmente, manipular experimentalmente para recrear aquellos cambios evolutivos en el laboratorio. Me impresionaron, por ejemplo, los experimentos que inducían el crecimiento de dientes en embriones de pollo (Kollar y Fisher, 1980), a pesar de que hace millones de años que las aves perdieron los dientes adultos. Más recientemente, me maravilló la investigación que comparaba el desarrollo del pico en varios pinzones de las Galápagos y después probó una hipótesis sobre los mecanismos moleculares subyacentes en esta variación mediante la manipulación de desarrollo del pico en embriones de pollos (Abzhanov, Protas, Grant, Grant y Tabin, 2004). Numerosos trabajos de esta clase han probado ahora que el estudio de la biología evolutiva del desarrollo se puede aplicar con provecho a la evolución de picos, extremidades, aletas y huesos. Pero me preguntaba si eso funcionaría con el cerebro, si la tremenda complejidad del cerebro echaría atrás a los neurobiólogos evolutivos del desarrollo. En cierta medida fue así, al menos al principio. Y sin embargo la neurobiología evolutiva del desarrollo ha crecido considerablemente en los últimos años y promete progresar todavía más en el futuro.
La neurobiología evolutiva del desarrollo
Hasta ahora, la mayoría de los neurobiólogos especializados en evo-devo no se han dedicado a explicar las diferencias cerebrales entre especies, sino a buscar similitudes inesperadas y crípticas. En esta tarea han destacado Luis Puelles y sus colaboradores (por ejemplo, Puelles et al., 2000). Estos autores compararon los patrones de expresión de numerosos genes en cerebros de embriones de mamíferos y aves, así como en los de otras especies de vertebrados, y descubrieron que estos patrones son muy similares entre estas especies, a pesar de tener un cerebro adulto muy diferente, especialmente el prosencéfalo (cerebro anterior). Estos descubrimientos encajan con el patrón general de divergencia en el desarrollo (en lugar de la recapitulación) que he expuesto anteriormente. Por otra parte, las similitudes en la expresión génica de embriones han permitido a Puelles et al. (2000) inferir numerosas homologías –caracteres equivalentes que se pueden remontar a un origen evolutivo único– que han permanecido sin explicación hasta que las formas adultas han dejado de ser las únicas que se tenían en cuenta. El mismo enfoque general se ha aplicado también para establecer homologías entre las principales regiones cerebrales de vertebrados e invertebrados (Holland, Holland, Williams y Holland, 1992; Denes et al., 2007).
«La mayoría de los neurobiólogos especializados en EVO-DEVO no se han dedicado a explicar las diferencias cerebrales entre especies, sino a buscar similitudes inesperadas y crípticas»
Aunque las similitudes en la expresión génica embrionaria han ayudado a aclarar algunas homologías, muchas continúan siendo controvertidas. Una de las razones de estos debates aparentemente interminables es que no todos los genes son igual de buenos como «indicadores de homología». Más prácticos son los genes que se expresan solamente en las estructuras de interés y que se sabe que están implicados en su desarrollo y su destino adulto (Medina, Abellán y Desfilis, 2013). Cuando estos «marcadores» ideales no están disponibles, la mejor opción es analizar la expresión de una gran cantidad de genes –a ser posible, todo el transcriptoma– para luego comparar las especies estadísticamente. Estadísticas diferentes pueden arrojar distintos resultados, pero el enfoque estadístico es ciertamente preferible a centrarse solamente en los genes que apoyan o contradicen una hipótesis en particular, lo que sería como elegir solo lo que más conviene. Estas comparaciones del transcriptoma ya se han aplicado a las regiones cerebrales de adultos, pero probablemente se producirán avances significativos cuando estos análisis se amplíen a las regiones cerebrales embrionarias. Al fin y al cabo, como decíamos antes, los cerebros embrionarios de distintas especies son en general más parecidos que los de adultos. Por otro lado, los genes que se expresan durante el desarrollo embrionario tienden más a participar en las redes de regulación génica que se cree que especifican la «identidad de caracteres».
Una vez se han identificado las homologías en las regiones cerebrales, ya se pueden correlacionar las diferencias en el nivel y la extensión espacial de la expresión génica embrionaria con las diferencias entre especies que presenta la morfología cerebral de los adultos. Por ejemplo, en mi laboratorio hemos visto que los loros adultos tienen un mesencéfalo extraordinariamente pequeño, en comparación con el de otras aves, y que esta diferencia en los individuos adultos se correlaciona con una diferencia específica de esta especie en el patrón de la expresión génica que está implicado en el desarrollo del mesencéfalo (McGowan, Kuo, Martin, Monuki y Striedter, 2011). Del mismo modo, otros científicos han demostrado que, entre un grupo de peces teleósteos, las diferencias que muestran los adultos en el tamaño de áreas específicas del prosencéfalo se correlacionan con las diferencias entre especies en la expresión de los genes implicados en establecer el patrón del cerebro anterior. De hecho, la manipulación de la expresión de estos genes puede recrear (fenocopia) algunas de las diferencias que presentan los individuos de diferentes especies (Sylvester et al., 2010).
«La ciencia es insaciable, quiere responder todas las preguntas, pero, en cada momento dado, solo puede responder algunos interrogantes»
Lo que continúan sin explicar estos estudios es la causa molecular de las diferencias entre especies en la expresión génica embrionaria. ¿Cómo es que la evolución alteró la regulación de estos genes? ¿Se añadieron algunos genes o secuencias reguladoras de ADN a redes génicas reguladoras ya existentes, o bien se eliminaron? Responder a estas preguntas es a menudo difícil porque los elementos de regulación génica pueden estar localizados bastante lejos de los genes regulados. Por otra parte, algunas diferencias en la expresión génica pueden deberse a cambios en el ADN que no implican cambios en la secuencia de ADN, es decir, que se trataría de modificaciones epigenéticas, pero que sin embargo se pueden transmitir entre generaciones.
Estas cuestiones sin resolver pueden entorpecer el progreso de la neurobiología evolutiva del desarrollo, pero sería un error argumentar que solo la genómica y la epigenómica pueden dar una explicación mecanicista al cambio evolutivo en la morfología cerebral. Al fin y al cabo, el desarrollo cerebral se puede estudiar mediante varios niveles diferentes de análisis –desde la regulación génica hasta la formación de tejidos– y cada nivel se puede considerar un «mecanismo causal» por derecho propio. Por ejemplo, mi trabajo ha demostrado que la expansión del telencéfalo en loros y aves canoras, comparada con la de otras aves, se debe a un retraso en la neurogénesis, lo cual incrementa el número de células precursoras del telencéfalo (Charvet y Striedter, 2009). Desconocemos el mecanismo molecular que subyace en este cambio durante el proceso de la neurogénesis, pero nuestro descubrimiento, sin embargo, es mecanicista. La biología es una disciplina que se organiza jerárquicamente, y cada especialista tiende a estudiar un nivel diferente; por eso lo que para un científico es un mecanismo, para otro es un fenómeno que necesita explicación. A la larga, la ciencia es insaciable, quiere responder todas las preguntas, pero en cada momento dado solamente puede alcanzar a responder algunos interrogantes. Como resumimos en la siguiente sección, un excelente modelo para ilustrar esta naturaleza multinivel de la neurobiología evolutiva del desarrollo es la formación de los pliegues del neocórtex en el cerebro de algunos mamíferos.
El plegamiento cortical: un sistema modelo para la neurobiología evolutiva del desarrollo
La mayor parte del córtex cerebral, el neocórtex, muestra pliegues complejos en los humanos y en otros mamíferos con grandes cerebros. De hecho, casi todos los cerebros de mamíferos que superan los 10 g suelen tener un neocórtex con pliegues, al contrario que los cerebros más pequeños. Por otra parte, el grado de pliegues corticales se incrementa previsiblemente con el área de la superficie cortical (especialmente cuando esta área se multiplica por la raíz cuadrada del espesor cortical). En general, estos datos indican que existe una relación causal entre la evolución del plegamiento cortical y el crecimiento evolutivo del área del neocórtex. Dicho de otra forma, el plegamiento neocortical evolucionó a medida que se fue incrementando la extensión del neocórtex de los mamíferos más allá de cierto umbral.

Figura 2. Plegamiento inducido experimentalmente en el techo óptico (tectum) de aves. La inyección del factor de transcripción FGF2 en los ventrículos cerebrales de embriones de pollo produce un retraso de la neurogénesis tectal y, como consecuencia, fuerza al techo óptico a crecer en volumen y, especialmente, en superficie (McGowan et al., 2011). Sorprendentemente, un techo óptico más grande desarrolla numerosos pliegues, lo que nunca pasa con un techo normal. Hemos sugerido que estos pliegues inducidos son el resultado directo de la expansión tangencial del crecimiento del tectum, lo que genera fuerzas mecánicas deformadoras. / Georg F. Striedter
La importancia de la función del plegamiento cortical continúa en discusión. Está claro, sin embargo, que sin los pliegues, el neocórtex formaría un enorme globo lleno de líquido, lo que complicaría el parto y dificultaría el equilibrio de la cabeza sobre el cuello. Además, el plegamiento cortical permite que los axones que conectan diferentes regiones del neocórtex entre sí y con el resto del cerebro sean más cortos que si el neocórtex fuese liso y tuviese forma de globo. Reducir al mínimo la longitud de los axones, a su vez, ahorra energía metabólica e incrementa la velocidad a la que las neuronas de diferentes áreas del cerebro se pueden comunicar. Estas ventajas funcionales sugieren que el plegamiento cortical tiene un origen adaptativo, es decir que su evolución ha incrementado las probabilidades de supervivencia y de reproducción de los individuos. Esta explicación «adaptacionista» de la evolución del plegamiento cortical no involucra el desarrollo, es decir, no es biología evolutiva del desarrollo, pero sí que es mecanicista; sin pliegues, los grandes neocórtex difícilmente habría evolucionado, a no ser que hubiese abandonado la organización cortical, en forma de lámina.
«Sería un error argumentar que solo la genómica y la epigenética pueden dar una explicación mecanicista al cambio evolutivo de la morfolofía cerebral»
Desde el punto de vista de la evo-devo, el plegamiento cortical es un fenómeno del desarrollo que requiere una explicación basada en el desarrollo: ¿Por qué el neocórtex, que es liso en las primeras etapas de desarrollo, empieza a plegarse en aquellas especies en las que el neocórtex adulto presenta pliegues? ¿Qué tipo de fuerzas generan los pliegues? Empezamos a pensar seriamente sobre esta cuestión en mi laboratorio tras manipular embriones de pollo para que desarrollasen un techo óptico o tectum más amplio. Para nuestra sorpresa, descubrimos que con la ampliación del techo óptico se desarrollaban varios pliegues (figura 2; McGowan et al., 2012). Aunque estábamos trabajando con aves y no con mamíferos, y más centrados en el tectum que en el neocórtex, empezamos a pensar que debía existir algún principio general que podría explicar el pliegue tisular en diferentes estructuras y especies.
Guiados por esta idea y apoyándonos en la extensa bibliografía sobre el plegamiento cortical, propusimos que en los mamíferos este se debe sobre todo a fuerzas que deforman el neocórtex y que se generan cuando la capa celular del neocórtex embrionario, denominada placa cortical, se expande y aumenta en superficie, tangencialmente, más rápidamente que el tejido que hay debajo (Striedter, Srinivasan y Monuki, 2015). Como muestran los modelos que se han estudiado, esta expansión diferencial produce el plegamiento una vez que aquella ha superado el umbral de deformación, que depende del espesor y la rigidez de las diferentes capas. Otros mecanismos adicionales, como la tensión que crea el crecimiento de los axones, pueden influir en el lugar concreto en el que se forman los pliegues. Dado este conjunto de causas, la razón por la que el córtex se pliega más en unas especies que en otras es que la placa cortical se expande mucho más (en área, no en espesor) en las especies con córtex más plegados (figura 3). Cuanto más crece, en relación con el tejido subyacente, mayor es la fuerza de la deformación y más se pliega el córtex.
Así pues, ¿a qué se deben las diferencias entre especies en el grado de expansión del córtex? Para responder esto hay que tener en cuenta que la placa cortical se genera a partir de células progenitoras localizadas justo debajo de esta placa (zona roja de la figura 3). En las especies con un córtex pequeño y liso, las células progenitoras se dividen inicialmente para formar otras progenitoras, pero enseguida empiezan a generar células hijas que no se volverán a dividir; estas células postproliferativas migran entonces radialmente hacia la emergente placa cortical y se diferencian en neuronas. Por el contrario, en las especies con córtex grande y con muchos pliegues, las células progenitoras corticales pasan por unas cuantas series de divisiones celulares adicionales antes de empezar a generar células postproliferativas. Debido a estas divisiones celulares adicionales, son muchas más las células que acaban migrando a la placa cortical, donde forman el neocórtex. Por otra parte, a medida que las neuronas jóvenes van migrando hacia la capa cortical, van empujando las células vecinas a un lado de tal manera que la capa cortical se va extendiendo tangencialmente, es decir, que la superficie se expande, aunque no gane en espesor de forma apreciable. Debido a esta «intercalación radial», el incremento evolutivo de neuronas neocorticales está asociado con una gran expansión de la superficie del córtex, que a su vez aumenta mucho menos en espesor. Esta expansión de la superficie, unida a una expansión mucho menor del tejido subyacente, incrementa las fuerzas deformantes que generan los surcos cerebrales.
«¿Qué cambios evolutivos en el ADN provocan que las células progenitoras corticales se dividan más en unas especies que en otras? Es difícil encontrar una respuesta sencilla»
¿Qué cambios evolutivos en el ADN provocan que las células progenitoras corticales se dividan más en unas especies que en otras? Es difícil encontrar una respuesta sencilla, porque hay una gran cantidad de moléculas diferentes que están involucradas en el control del ciclo celular, y muy posiblemente la expansión evolutiva de las células progenitoras corticales se basa en diferentes mecanismos moleculares en diferentes linajes. Sin embargo, este problema se ha estudiado con éxito en una especie muy interesante, la nuestra (Florio et al., 2015). Este trabajo ha mostrado que el gen ARHGAP11B apareció en la especie humana poco después de la divergencia del linaje de los chimpancés debido a una duplicación parcial de un gen ancestral. Expresando artificialmente este gen en células progenitoras del córtex de ratones se forzó a dichas progenitoras a generar una cantidad inusualmente grande de «células progenitoras basales», lo que incrementó la cantidad total de progenitoras del córtex. Todavía más fascinante fue que la mitad de los ratones que expresaban ARHGAP11B en sus progenitoras del córtex acabasen desarrollando pliegues corticales que parecían bastante similares a los de la corteza humana. Así pues, la evolución de novo de ARHGAP11B es probablemente una de las causas moleculares principales de la expansión y el plegamiento del córtex en el linaje humano.
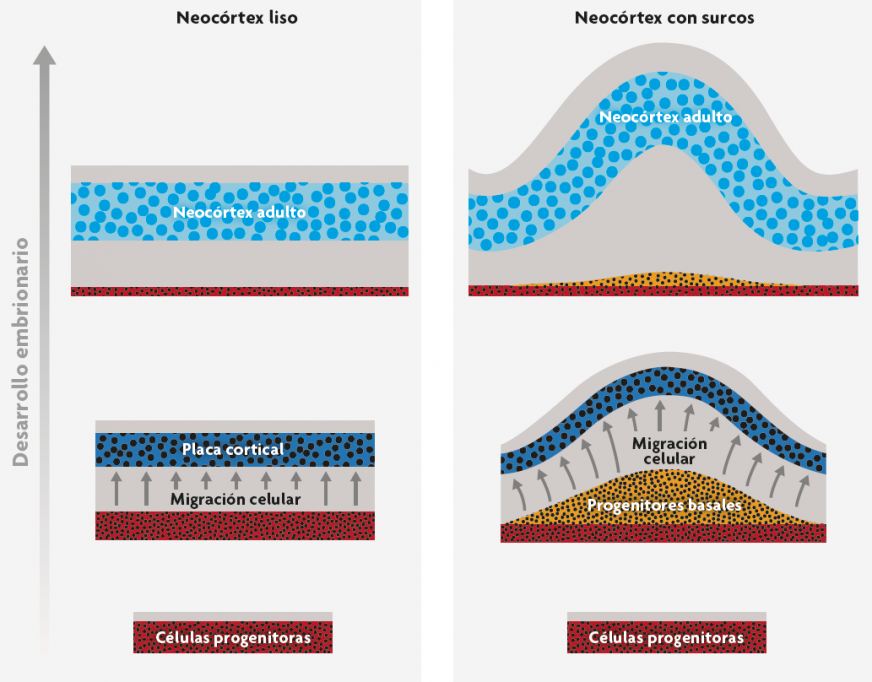
Figura 3. Mecanismo de desarrollo para la evolución de los pliegues del neocórtex. Cuando las células progenitoras del córtex dejan de dividirse, migran radialmente fuera de la zona progenitora (rojo) para formar una placa cortical densa en células (azul oscuro). A medida que avanza el desarrollo la placa cortical se expande y, finalmente, da lugar al neocórtex adulto (azul claro). En las especies con neocórtex con pliegues (derecha), las células progenitoras se dividen más frecuentemente y suelen formar una capa extra de «progenitoras basales». Esta expansión del grupo de progenitoras genera más neuronas que migran hacia la placa cortical. Estas neuronas migradoras se insertan en la placa cortical de tal manera que esta se expande tangencialmente mucho más de lo que aumenta en grosor. Como el tejido subyacente no se expande tangencialmente tan deprisa, la capa cortical empieza a deformarse y a plegarse. A medida que la placa cortical va madurando y se transforma en un neocórtex adulto, los pliegues más tempranos se van marcando de forma más prominente (Striedter et al., 2015). / Georg F. Striedter
Fronteras de la neurobiología evolutiva del desarrollo
el plegamiento cortical y sobre otros sistemas modelo de la biología evolutiva del desarrollo, probablemente se irán conociendo más mecanismos subyacentes de cada fenómeno. Algunos de estos mecanismos ocuparán diferentes niveles de análisis, y por eso es importante clarificar cómo se relacionan entre sí (Striedter, 1998). Incluso dentro de un nivel determinado, probablemente salgan a la luz múltiples mecanismos. Por ejemplo, la evolución de ARHGAP11B es probablemente uno de los muchos mecanismos moleculares que dirigen la expansión y el plegamiento del córtex, incluso en el linaje humano. A medida que esta diversidad de mecanismos entra en juego, será importante distinguir entre los principales factores causales –lo que algunos han llamado «mediadores»– y los menos importantes –los que se podrían denominar «moduladores»–. No siempre será una distinción fácil, especialmente si en cada linaje predominan mecanismos diferentes pero generan morfologías similares. Incluso en el caso de que una manipulación experimental bien definida, como la expresión de ARHGAP11B en ratones, produzca un fenotipo que parezca una variante evolutiva, eso no probaría que el mecanismo manipulado fuese la principal causa del cambio filogenético natural. No olvidemos que en biología a menudo existe más de una vía para resolver un problema, más de una vía para construir un determinado fenotipo.
«Desde el punto de vista de la evo-devo, el plegamiento cortical es un fenómenos que requiere una explicación basada en el desarrollo»
Aun así, el uso de manipulaciones experimentales para fenocopiar aunque solo sean algunos aspectos del cambio evolutivo puede ser muy útil. Particularmente interesante sería explorar cómo el resto del sistema biológico responde a la manipulación específica. Por ejemplo, hace tiempo propuse que el crecimiento evolutivo de tamaño de una zona cerebral, en comparación con el resto del cerebro, podía hacer que la zona que había crecido se proyectase hacia una variedad mayor de dianas y que recibiese una mayor variedad de aferencias o inputs (Striedter, 2005). Esta hipótesis está apoyada por varios datos basados en correlación, pero todavía no se ha probado experimentalmente. Para efectuar una prueba de este tipo se podría, por ejemplo, expresar ARHGAP11B en las células corticales progenitoras de ratones y después examinar si las cortezas adultas ampliadas y plegadas generan más conexiones axonales de las naturales en ratones normales. Probar esta hipótesis sería interesante porque implicaría la existencia de mecanismos de desarrollo que ayudarían a integrar los cambios evolutivos en una parte del sistema nervioso con el resto del sistema obviando la necesidad de cambios genómicos adicionales para llevar a cabo dicha integración.
De forma más general, sería interesante descubrir el grado en que las manipulaciones experimentales dirigidas específicamente a una zona del cerebro o un mecanismo tienen efectos posteriores en cascada en otras regiones y mecanismos cerebrales y hasta qué punto estos efectos en cascada son adaptativos. Me fascina, por ejemplo, el descubrimiento de que cabras que han nacido sin las patas anteriores puedan aprender a caminar con las dos posteriores (de forma bípeda) y después desarrollar cambios adaptativos en varias partes de su cuerpo para amoldarse a esta nueva forma de locomoción (West-Eberhard, 2005). Sospecho que el sistema nervioso también está dotado de esta plasticidad tan útil; de hecho, este tipo de plasticidad en el desarrollo podría ser adaptativa en el sentido de que promueve la evolucionabilidad (capacidad para evolucionar).
Sería interesante descubrir el grado en que las manipulaciones experimentales dirigidas específicamente a una zona del cerebro tienen efectos posteriores en cascada en otras regiones
«Sería interesante descubrir el grado en que las manipulaciones experimentales dirigidas específicamente a una zona del cerebro tienen efectos posteriores en cascada en otras regiones»
Igual de interesante es la idea de que los sistemas nerviosos en desarrollo podrían ser resistentes ante muchas perturbaciones, como las producidas por las variaciones genéticas o ambientales naturales dentro de una población. La idea de estos «mecanismos de amortiguación o tamponamiento» del desarrollo se remonta al menos a Conrad Waddington (Striedter, 1998), pero el fenómeno es difícil de estudiar porque, al fin y al cabo, las manipulaciones relevantes no producen un fenotipo adulto. Aun así, los mecanismos que proporcionan esta resistencia a la perturbación se pueden estudiar experimentalmente, y cada vez son más susceptibles de someterse al análisis matemático y a la modelización (por ejemplo, Lander, 2011). En general, creo que los sistemas nerviosos han evolucionado para equilibrar la necesidad de que el desarrollo sea estable con la necesidad de que pueda evolucionar. Entender cómo se alcanza y se gestiona este equilibrio a lo largo de la evolución sería, a mi parecer, un objetivo digno de la neurobiología evolutiva del desarrollo.
REFERENCIAS
Abzhanov, A., Protas, M., Grant, B. G., Grant, P. R., & Tabin, C. J. (2004). BMP4 and morphological variation of beaks in Darwin’s finches. Science, 305, 1462–1465. doi: 10.1126/science.1098095
Charvet, C. J., & Striedter, G. F. (2009). Developmental origins of mosaic brain evolution: Morphometric analysis of the developing zebra finch brain. The Journal of Comparative Neurology, 514(2), 203–213. doi: 10.1002/cne.22005
Denes, A. S., Jékely, G., Steinmetz, P. R. H., Raible, F., Snyman, H., Prud’homme, B., … Arendt, D. (2007). Molecular architecture of annelid nerve cord supports common origin of nervous system centralization in bilateria. Cell, 129(2), 277–288. doi: 10.1016/j.cell.2007.02.040
Florio, M., Albert, M., Taverna, E., Namba, T., Brandl, H., Lewitus, E., … Huttner, W. B. (2015). Human-specific gene ARHGAP11B promotes basal progenitor amplification and neocortex expansion. Science, 347, 1465–1470. doi: 10.1126/science.aaa1975
Gilbert, S. F., Opitz, J. M., & Raff, R. A. (1996). Resynthesizing evolutionary and developmental biology. Developmental Biology, 173(2), 357–372. doi: 10.1006/dbio.1996.0032
Gould, S. J. (1977). Ontogeny and phylogeny. Cambridge, MA: Harvard University Press.
Holland, P. W. H., Holland, L. Z., Williams, N. A., & Holland, N. D. (1992). An amphioxus homeobox gene: Sequence conservation, spatial expression during development and insights into vertebrate evolution. Development, 116, 653–661.
Kollar, E. J., & Fisher, C. (1980). Tooth induction in chick epithelium: Expression of quiescent genes for enamel synthesis. Science, 207, 993–995. doi: 10.1126/science.7352302
Lander, A. D. (2011). Pattern, growth, and control. Cell, 144, 955–969. doi: 10.1016/j.cell.2011.03.009
McGowan, L., Kuo, E., Martin, A., Monuki, E. S., & Striedter, G. (2011). Species differences in early patterning of the avian brain. Evolution, 65, 907–911. doi: 10.1111/j.1558-5646.2010.01126x
McGowan, L. D., Alaama, R. A., Freise, A. C., Huang, J. C., Charvet, C. J., & Striedter, G. F. (2012). Expansion, folding, and abnormal lamination of the chick optic tectum after intraventricular injections of FGF2. PNAS, 109(S1), 10640–10646. doi: 10.1073/pnas.1201875109
Medawar, P. B. (1967). The art of the soluble. Londres: Methuen.
Medina, L., Abellán, A., & Desfilis, E. (2013). A never-ending search for the evolutionary origin of the neocortex: Rethinking the homology concept. Brain, Behavior and Evolution, 81(3), 150–153. doi: 10.1159/000348282
Puelles, L., Kuwana, E., Puelles, E., Bulfone, A., Shimamura, K., Keleher, J., … Rubenstein, J. L. R. (2000). Pallial and subpallial derivatives in the embryonic chick and mouse telencephalon, traced by the expression of the genes Dlx-2, Emx-1, Nkx-2.1, Pax-6, and Tbr-1. The Journal of Comparative Neurology, 424, 409–438. doi: 10.1002/1096-9861(20000828)424:3<409::AID-CNE3>3.0.CO;2-7
Striedter, G. F. (1998). Stepping into the same river twice: Homologues as recurring attractors in epigenetic landscapes. Brain, Behavior and Evolution, 52, 218–231. doi: 10.1159/000006565
Striedter, G. F. (2005). Principles of brain evolution. Sunderland, MA: Sinauer Associates.
Striedter, G. F., Srinivasan, S., & Monuki, E. S. (2015). Cortical folding: When, where, how, and why? Annuals Reviews of Neuroscience, 38, 291–307. doi: 10.1146/annurev-neuro-071714-034128
Sylvester, J. B., Rich, C. A., Loh, Y.-H. E., von Staaden, M. J., Fraser, G. J., & Streelman, J. T. (2010). Brain diversity evolves via differences in patterning. PNAS, 107, 9718–9723. doi: 10.1073/pnas.1000395107
West-Eberhard M. J. (2005). Phenotypic accommodation: Adaptive innovation due to developmental plasticity. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution, 304, 610–618. doi: 10.1002/jez.b.21071





