© M. Lorenzo El futuro de la alimentación es la nutrición personalizada, es decir, dietas inteligentes diseñadas de acuerdo con las demandas específicas de genotipos individuales y de su historia. |
||
|
Nutrigenomics: personalized nutrition. Actualmente es creciente el conocimiento alrededor de las relaciones entre salud y alimentación. Es muy conocida la relación entre nuestro bienestar y longevidad con la diversidad bioquímica de los alimentos que comemos, además de otros condicionamientos ambientales. Al mismo tiempo también va aumentando la difusión del hecho de que las amplias diferencias que se dan entre individuos en la respuesta a la alimentación dependen de las características particulares codificadas en nuestros genes y de las adaptaciones implementadas en las diferentes condiciones experimentadas por cada persona a lo largo de su vida. En torno a esto surge la nutrigenómica, como disciplina emergente que estudia cómo interaccionan los alimentos y sus componentes con la información codificada en nuestros genes y con todo el entramado metabólico que se deriva de ello, así como sus consecuencias a todos los niveles. La nutrigenómica pretende el conocimiento extensivo e integrado de cómo las dietas o sus componentes afectan a los sistemas biológicos a todos los niveles, desde la expresión de la información genética que los caracteriza (transcriptoma), su composición en proteínas (proteoma) y las diferentes biomoléculas o metabolitos que los constituyen (metaboloma) y cómo todo eso se traduce en el funcionamiento de estos sistemas y repercute en el organismo completo. La nutrigenómica se ocupa también de conocer y caracterizar la diferente respuesta a la alimentación según el genotipo (nutrigenética) y según la historia alimentaria individual (epigenética). A menudo nutrigenómica y nutrigenética se consideran dos disciplinas diferentes. La nutrigenética, o genómica nutricional, pretende entender cómo las características genéticas de un individuo determinan su respuesta a la dieta, y para conseguirlo, esta disciplina se basa en la consideración de los polimorfismos subyacentes. Al abrazar un campo más amplio, la nutrigenómica trata de determinar la influencia de los alimentos sobre el genoma, y trata de relacionar los diferentes fenotipos resultantes con la respuesta genética, celular o fisiológica y, en general, del sistema biológico. Así también comprende el estudio de la respuesta diferencial asociada a genotipos (nutrigenética) y a fenotipos particulares. Un objetivo último de la nutrigenómica es también el desarrollo de alimentos que se ajusten a las conveniencias de salud de personas individuales. En realidad, el verdadero reto de fondo es la integración de toda la información, la de los datos y conocimientos aportados por las nuevas tecnologías ómicas (genómicas y postgenómicas), con las que aporta la nutrición clásica y el metabolismo humano; todo lo que permite revelar los efectos de un agente externo sobre un organismo. No es extraño, pues, que al ritmo de los avances vayan surgiendo nuevos términos y conceptos como el de «biología de sistemas», «metabolismo integrado» o «biología nutricional de sistemas», que tratan de delimitar parcelas concretas del conocimiento. Aquí consideramos que el término «nutrigenómica» es bastante amplio y apropiado para englobar, por lo menos de momento, todos estos nuevos desarrollos en el ámbito de la alimentación y la salud a que nos hemos referido. En realidad, tenemos conocimientos nutrigenómicos desde hace muchos años y los aplicamos; como por ejemplo cuando restringimos la dieta de determinadas personas afectadas por enfermedades debidas a variantes o mutaciones génicas individuales (los denominados errores congénitos del metabolismo) o cuando se prescribe no ingerir determinados alimentos a ciertos grupos de población que, a diferencia de otros, presentan reacciones adversas frente a un determinado componente alimentario. No obstante, el marco que configura la nutrigenómica es mucho más amplio, considera los polimorfismos (las diferentes variantes génicas), en los que la presencia de un alelo u otro supone sólo cierta diferencia, aunque sea pequeña, por lo que respecta a determinada función, y considera también las combinaciones de múltiples variantes que, tratadas individualmente, pueden no tener efecto funcional pero que en combinación determinan nuevas propiedades (Palou et al., 2004). Asimismo incluye la historia metabólica de cada persona, el resultado de la exposición a diferentes nutrientes y otros factores a lo largo de las diferentes etapas de la vida (epigenética); sin duda esta historia individual contribuye significativamente a una respuesta también individualizada. Considera también los mecanismos implicados en los efectos de la alimentación y la trascendencia de estos efectos a todos los niveles fenotípicos y, en particular, cómo afectan a la balanza que, por ambos lados, conduce hacia la función o la disfunción, la salud o la enfermedad. |
«La nutrigenómica pretende el conocimiento extensivo e integrado de cómo las dietas o sus componentes afectan a los sistemas biológicos a todos los niveles» | |
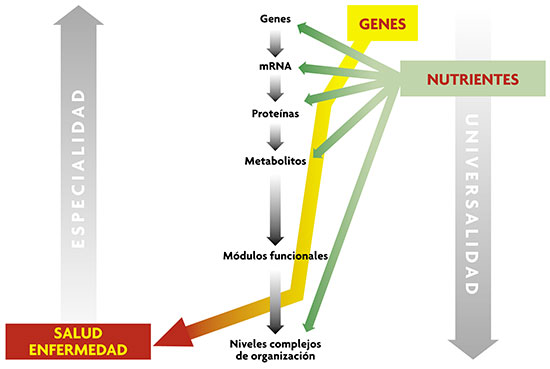 © Mètode © MètodeLos efectos de los alimentos sobre los sistemas biológicos se pueden describir mediante la información nutrigenómica (perfil genético, expresión de RNA mensajeros, proteínas y metabolitos). Estos efectos pueden consistir en cambios o desplazamientos del sistema que controla el peso corporal y contribuir así a la obesidad; en nutrigenómica nos gustaría que la descripción de los genes / expresión génica / proteínas / metabolitos, en una persona, nos permitiese predecir las posibles desviaciones de su homeostasis ya en las personas sanas, es decir, antes de que los sistemas hubiesen quedado irreversiblemente decantados hacia el desarrollo, a corto, medio o largo plazo, de enfermedades. (Adaptado de Oltvai y Barabasi, 2002.) |
«La nutrigenómica se ocupa de conocer y caracterizar la diferente respuesta a la alimentación según el genotipo y según la historia alimentaria individual»
«En realidad tenemos conocimientos sobre nutrigenómica desde hace muchos años, y los aplicamos» |
|
|
Las nuevas tecnologías en la nutrigenómica La nutrigenómica utiliza las técnicas tradicionales en metabolismo y nutrición pero también las nuevas tecnologías bioquímicas y, en particular, las denominadas tecnologías ómicas (transcriptómica, proteómica, metabolómica). Se nutre de los rápidos avances en el conocimiento de los genes que conforman el genoma, sus mecanismos de regulación y cómo ciertos componentes de los alimentos inciden en estos sistemas; y se beneficia de los grandes progresos en el conocimiento de la bioquímica y fisiología humana y, concretamente, del metabolismo. Así, la nutrigenómica dota de un valor añadido los conocimientos epidemiológicos y los contenidos clásicos de la nutrición, confiriendo a esta ciencia una sólida capacidad predictiva. Estas tecnologías modernas han capitalizado la gran cantidad de información aportada sobre todo a raíz de la secuenciación del genoma humano; el estudio de los genes, proteínas y metabolitos y la relación que mantienen con otros componentes y parámetros celulares y tisulares ha ido derivando en la adopción de las numerosas denominaciones (más de 50) de técnicas o tecnologías acabadas con el sufijo -ómico -a u -oma (del griego, “completo”) que aparecen en la literatura científica. El consorcio para los SNP (Single Nucleotide Polymorphisms) está localizando numerosos polimorfismos en el genoma humano que determinan diferencias en las características fenotípicas individuales que se encuentran en la población. La genómica se puede describir como el estudio y caracterización de la secuencia de todos los genes presentes en una determinada especie. Derivados de ella, podemos considerar la «genómica funcional», que cubre los aspectos del conocimiento de las funciones de los diferentes genes y como estos genes interaccionan o se influyen entre sí, y la transcriptómica, que utiliza las tecnologías de microchips (microarrays) de cDNA o de oligonucleótidos como aproximaciones para analizar la expresión génica (se pueden determinar miles de mRNA en cualquier muestra biológica en unas determinadas condiciones). El transcriptoma es el conjunto de todos los mRNA de un fluido, célula, tejido o muestra biológica en general. En estos momentos es la tecnología ómica más sobradamente utilizada y la que goza de unas mejores posibilidades de validación y estandarización para, prácticamente, todos los mRNA trascritos, aunque se requiere una cantidad de muestra relativamente grande para aislar bastante cantidad del mRNA que se necesita. La proteómica pretende determinar todas las proteínas de una muestra biológica, incluyendo la abundancia relativa, distribución, modificaciones post-traduccionales, funciones e interacciones con otras moléculas biológicas y, aunque se van obteniendo ya resultados, en estos momentos se perfilan desarrollos tecnológicos que la convertirán en una técnica muy poderosa. La metabolómica (o metabonómica, menos preferible aquí por estar más asociado al perfil de metabolitos en los estudios de fármacos) puede definirse como el análisis cuantitativo de todos los metabolitos, endógenos y exógenos, de un determinado fluido biológico, tejido o, en general, de un sistema biológico determinado. Independientemente de que la proteómica y, más aún, la metabolómica requiera del bagaje de más estudios que nos provean de estándares y procedimientos de rutina, aplicables de manera generalizada para el desarrollo completo de los objetivos de estas técnicas en nutrición, hacen falta más herramientas matemáticas. Hoy no tenemos tratamientos apropiados para los muchos miles de datos que generan los estudios y, aun siendo difícil de precisar, creemos que se procesa menos del 2% de la información obtenida; el resto se pierde. Esto obliga a aplicar estrategias de selección de los parámetros a analizar, que permiten abaratar el coste de los procesos, si bien no está claro que sea la opción más apropiada. Una herramienta fundamental pendiente es el establecimiento de perfiles ómicos definitorios de estados de «salud estándar» que puedan servir como referencia o control en los diferentes estudios. Análogamente podemos referirnos al establecimiento de perfiles nutrigenómicos para otras condiciones como la diabetes mellitus tipo 2, las obesidades y otras enfermedades o condiciones fisiológicas de interés (ver más adelante). Una de las mayores dificultades la encontramos a la hora de analizar los conjuntos de datos y variables de manera combinada, teniendo en cuenta, además, que corresponden a diferentes coordenadas de un espacio multidimensional, definido por campos distintos (genético, clínico, nutricional, metabólico, metabolómico, etc. y otros variables) que reflejan, cada uno con pautas y leyes particulares, la información sobre los procesos homeostáticos y los equilibrios entre salud y enfermedad. La determinación de fenotipos de salud nutricional (FSN) útiles (ver más adelante) constituye uno de los mayores retos. Biomarcadores nutrigenómicos Un elevado número de revisiones ya ilustran la capacidad de identificar en edades tempranas determinadas sensibilidades de las personas a enfermedades relacionadas con la dieta, lo que podría reforzar (junto al asesoramiento dietético y de estilo de vida, y al conocimiento de interacciones dieta-genotipo) los beneficios de la dieta sobre la salud humana y avanzar en el conocimiento de las bases científicas de la relación entre dieta y salud. En nutrigenómica pretendemos describir el sistema biológico (el funcionamiento de una célula, tejido, sistema biológico en general, o nuestro organismo completo en el caso más amplio que aquí nos interesa) en «su totalidad»; en términos de su composición de miles de mRNA, proteínas y metabolitos, y las combinaciones de todos ellos. Con eso nos gustaría poder describir «completamente» cada sistema homeostático, para poder percibir desplazamientos de este sistema, previos a la aparición de alteraciones o factores de riesgo que tarde o temprano puedan dar lugar a determinadas alteraciones más definidas (enfermedades u otros fenotipos que nos interesen). En este sentido, los biomarcadores nutrigenómicos resultan de conjuntos de datos característicos de la respuesta (a la dieta o a una determinada composición o pauta alimentaria) del sistema biológico considerado, indicativos de la derivación del sistema hacia una determinada condición considerada potencialmente adversa; por ejemplo, hacia el desarrollo de hipertensión. Son ya numerosos los estudios nutrigenómicos que muestran relación entre los componentes de la dieta y la salud. Algunos ejemplos son el papel de los ácidos grasos en el desarrollo de esteatosis hepática o del hígado graso, el efecto del calcio y del hemo sobre el riesgo de cáncer de colon, o los efectos del aceite de oliva, del alcohol, de la vitamina D, etc. Es lógico que un perfil completo de muchos biomarcadores, basados en centenares o miles de parámetros, represente más fielmente el estado de salud o bienestar que los actuales y escasos biomarcadores, disponibles rutinariamente. Entre las dificultades actuales que hay que superar está el hecho de que, de momento, se requiere una cantidad relativamente grande de muestra para aislar bastante material para hacer los análisis y el hecho de que, en general, el acceso a tejidos humanos (descontando sangre, orina y otros fluidos y descamaciones, practicables fácilmente) es limitado. Si bien las biopsias de piel, músculo y tejido adiposo son relativamente accesibles y pueden llegar a serlo de manera sencilla, los diferentes tipos de células sanguíneas ofrecen a priori las más interesantes posibilidades. En el futuro nos espera el desarrollo de nuevas técnicas de análisis no invasivas. Es posible determinar perfiles tisulares característicos e identificar genes candidatos, por ejemplo en relación con la obesidad, o bien marcadores de efectos de nutrientes, como la vitamina D, o identificar varios agentes y contaminantes de interés en seguridad alimentaria. Se han descrito patrones específicos de expresión genética en células sanguíneas asociadas a enfermedades como tumores pulmonares o leucemia que pueden servir como marcadores de enfermedad, pero está pendiente la cuestión sobre los biomarcadores de preenfermedad, previos a la aparición de los factores y signos de riesgo tradicionalmente considerados. |
||
 © M. Lorenzo La exposición al tabaco o el ejercicio físico pueden considerarse factores menores, a pesar de ser importantes, si los comparamos con la exposición continuada a los alimentos a lo largo de nuestra vida. |
«Un objetivo último de la nutrigenómica es el desarrollo de alimentos que se ajusten a las conveniencias de salud de personas individuales» | |
|
Hasta ahora, y aunque muchas experiencias no han sido publicadas y por lo tanto no se han podido compartir (un problema que debe solucionar la comunidad científica, particularmente los editores), puede deducirse que la variabilidad interindividual observada es elevada, si bien es cierto que con los datos que se obtienen es factible establecer concordancias; por ejemplo, ya se obtienen resultados bastante reproductibles de cada individuo si se ajustan bien las condiciones, ritmos diarios, estacionales, formas de alimentación, etc. De esta manera los perfiles nutrigenómicos se presentan como una estrategia muy prometedora para avanzar en el conocimiento de la respuesta fenotípica a las intervenciones nutricionales. En torno a las recomendaciones en la alimentación actual En general, vale la pena notar que la exposición al tabaco o a otras toxinas, o el ejercicio físico, que sabemos que son agentes muy capaces de determinar nuestra salud, son factores que pueden considerarse menores comparados con nuestra exposición continuada a los alimentos a lo largo de toda la vida; los alimentos constituyen el principal factor medioambiental que pone a prueba nuestro organismo. Los referentes de calidad en alimentación han cambiado y las demandas del consumidor cambian de manera acelerada. Mientras que durante el siglo pasado las preocupaciones se centraron primero en asegurar la disponibilidad de alimentos básicos y, posteriormente, en asegurarse que fuesen inocuos, y en nutrición prevenir las enfermedades carenciales, asegurando un suministro adecuado de macronutrientes y componentes esenciales; hoy nuestra sociedad se concentra más en afrontar (y de manera clave a través de la alimentación) las denominadas enfermedades crónicas de nuestro tiempo: enfermedades cardiovasculares, diabetes, obesidad, varios tipos de cáncer, osteoporosis y enfermedades autoinmunes. El consumidor en nuestras sociedades desarrolladas, con un crecimiento de la capacidad adquisitiva, no se conforma con exigir que los alimentos sean seguros, que la disponibilidad esté asegurada y que sean inocuos, y no se contentará con lo que tradicionalmente se esperaba de los alimentos (energía, nutrientes para la construcción o renovación de nuestras estructuras corporales, que nos satisfagan el hambre y el placer de comer, su papel en las relaciones sociales y en las tradiciones, que la producción sea respetuosa con el bienestar animal y con el medio ambiente). Además de todo eso, espera que los alimentos le proporcionen más salud y bienestar (alimentos funcionales). La legislación alimentaria europea se adapta a los nuevos escenarios. A finales de 2006 concluía en Europa el amplio debate de la propuesta sobre Declaraciones Nutricionales y Declaraciones de Salud en los Alimentos (ver el Reglamento (CE) núm. 1924/2006 relativo a las declaraciones nutricionales y de propiedades saludables en los alimentos, Diario Oficial de la Unión Europea L 12, 3-18, de 18 de enero de 2007), una iniciativa de la CE sobre las normas que deben regir uniformemente en todos los estados miembros para reducir la situación actual de anarquía en la publicidad sobre alimentos-salud (cada país hacía su propia interpretación –a menudo oscilante– de las propiedades o beneficios que pueden ser o no alegados en etiquetas, anuncios, etc.), que favorece la proliferación de publicidad engañosa, no sustentada en evidencias científicas, y afecta a todos los consumidores, incluyendo la población infantil y juvenil. La nueva legislación incluye prohibiciones de alegaciones nutricionales o de salud para aquellos alimentos que no tengan un «perfil nutricional» mínimamente saludable (alimentos ricos en grasa saturada, sal, etc.), perfil que debe ser evaluado de manera independiente por el panel de nutrición del EFSA (European Food Safety Authority). La idea subyacente es que sólo se deben permitir las alegaciones de salud probadas científicamente y, dado que las alegaciones de salud pueden estimular el consumo de aquellos alimentos que gocen de ellas, no parece razonable que las alegaciones beneficien el consumo de alimentos con un perfil nutricional inadecuado. Puede que, de momento, sea políticamente más correcto continuar diciendo que no hay alimentos buenos o malos (porque es cierto que los efectos dependen de la dosis); pero el conocimiento científico aporta cada día más evidencia de que hay diferencias muy marcadas entre los diferentes alimentos, y no deben ser ignoradas. Además, aunque hoy día ya se han implantado recomendaciones dietéticas para mejorar la salud y disminuir el riesgo de ECV, cáncer, hipertensión, diabetes tipo 2, obesidad, y otras enfermedades crónicas, con beneficios probados según las estadísticas, la verdad es que estas recomendaciones se han establecido sobre la base de la población general y no de manera individual. Sin desconsiderar los beneficios en general, las diferencias tan drásticas en las respuestas de cada persona individual a una determinada dieta ponen de manifiesto las limitaciones de estas recomendaciones generales, y también que conocemos los mecanismos de manera muy parcial. En paralelo a una mejor formación e información nutricional del consumidor, los cambios irán dando paso desde una posición «paternalista» de la administración (con recomendaciones generales para comer de manera saludable y variada en general y que aseguran –con refuerzo de alimentos si se considera necesario– la ausencia de carencias) hasta una situación que propicia más la elección, fundamentada, del consumidor de aquellos alimentos e ingredientes de la dieta que más le convengan a su salud y bienestar. Alimentos funcionales y dietas inteligentes La capitalización de los conocimientos sobre nuevos beneficios para la salud y el bienestar que se van delimitando es la base para el desarrollo de los llamados alimentos funcionales. Ciertos componentes alimentarios y dietas resultan ser capaces de decantar adaptaciones de nuestro organismo, dado que afectan al mantenimiento de equilibrios homeostáticos determinantes de las condiciones de salud y bienestar, en el sentido de favorecer o prevenir determinadas enfermedades crónicas u otras condiciones de interés. |
||
 © M. Lorenzo Hoy en día los consumidores no se conforman con la disponibilidad y seguridad de los alimentos, quieren que, además, les proporcionen salud y bienestar. |
«La nutrigenómica permitirá mejorar tanto la seguridad como la eficacia de los alimentos» | |
|
La nutrigenómica permitirá mejorar tanto la seguridad como la eficacia de los alimentos porque proporcionará un nivel de comprensión más preciso de las influencias de los alimentos y sus componentes en nuestros sistemas homeostáticos, con nuevas aproximaciones para la determinación de efectos, beneficiosos o adversos, en fases precoces; por ejemplo, anticipadamente al desarrollo de una enfermedad. Eso incluye la alimentación dirigida a subgrupos de población e incluso la nutrición personalizada, dietas inteligentes diseñadas de acuerdo con las demandas específicas de genotipos individuales y de su historia. Por ejemplo, se puede pensar (y ya ha aparecido propaganda comercial temeraria al respecto) que a partir de una pequeña muestra de sangre o a partir de otro tipo de muestra fácilmente obtenible, se puede efectuar (y se podrá hacer fácilmente, con rapidez y a un coste aceptable) una prospección nutrigenómica (transcriptómica, proteómica, metabolómica), contrastar los resultados con los del DNA del individuo (igualmente mensurable) y así poder obtener una selección inteligente de dietas variadas, saludables (recomendables, por ejemplo, para los próximos veinte días), equilibradas en macronutrientes y micronutrientes y con la carga óptima de compuestos bioactivos, además de gustosas. Las principales dificultades que deberían superarse tienen la raíz en la misma complejidad de los alimentos y prácticas alimentarias, y en la complejidad también de nuestros sistemas metabólicos y sus sutiles interregulaciones, asimismo, hay que tener en cuenta los problemas de percepción social, cuestiones éticas e implicaciones económicas y sociales. Actualmente se está acumulando mucha información; el genotipaje de los individuos que participan en estudios dietéticos de intervención se ha incorporado a muchos de los protocolos de estudio a gran escala; los estudios a gran escala observacionales de las relaciones entre dieta y enfermedad también van incorporando la investigación de las interacciones entre dieta y genotipo. El concepto de nutrición individualizada, el consejo dietético adaptado a cada individuo, ha seducido la imaginación de los investigadores de la nutrición tanto en salud pública como en terapéutica. Pero hemos dicho imaginación y no aplicabilidad y comercialización inmediata. Las oportunidades para la industria alimentaria a la hora de proporcionar alimentos funcionales y productos específicos adaptados a subgrupos según genotipos específicos también han sido reconocidas, y el dogma general que dice que en una dieta «caben o encajan todos los alimentos» ha empezado a cuestionarse. Los atractivos que ofrece la nutrición personalizada, así como las implicaciones éticas y sociales que presenta, han atraído la atención de los medios generales de comunicación. Teniendo en cuenta las tendencias actuales y la disponibilidad ya de platos preparados de todos los tipos y características, con sabores y olores que reflejan fielmente los orígenes tradicionales, reconocibles, deberíamos afrontar el conocimiento de la respuesta nutrigenómica a estos preparados tan complejos, y no sólo el conocimiento del perfil nutrigenómico de nutrientes o componentes individuales de los alimentos. |
||
|
Epigenética y desarrollo de enfermedades La alimentación, particularmente durante las etapas tempranas del desarrollo, puede condicionar fuertemente nuestra salud a lo largo de la vida. Así, la alimentación de la futura madre constituye un factor primordial –más de lo que anteriormente se pensaba– en el desarrollo del niño, especialmente en lo que concierne a su futura salud y resistencia a enfermedades. Actualmente se sabe que algunas enfermedades que se presentan en la edad adulta, y que eran atribuidas a un estilo de vida malsano o a factores genéticos, son el resultado directo del entorno uterino durante el embarazo o de la alimentación durante la lactancia. Numerosos estudios epidemiológicos amplios realizados en los últimos veinte años han demostrado que las condiciones nutricionales durante etapas críticas del desarrollo, especialmente la gestación y período posnatal temprano (principalmente la lactancia) afectan a la susceptibilidad de sufrir determinadas enfermedades en edad adulta, entre ellas enfermedad cardiovascular, obesidad, diabetes tipo 2, osteoporosis y otros problemas y alteraciones. Los mecanismos biológicos subyacentes no son bien conocidos, sin embargo, tal como se deduce de estudios realizados en modelos animales o in vitro, las diferencias son causadas por la interacción entre componentes de los alimentos (u otros factores ambientales) con nuestros cromosomas, que conducen a un imprinting o programación de esquemas metabólicos particulares en los individuos, incluyendo cambios permanentes (epigenética) que se transmiten en la multiplicación celular y que pueden conferir una susceptibilidad diferente a sufrir alteraciones en edad adulta. Los estudios realizados en los últimos años en nuestro laboratorio nos han permitido describir una nueva función para una de estas proteínas que se encuentran de manera natural en la leche materna humana y que no está presente en fórmulas infantiles: la leptina, cuya nueva función durante la lactancia es conferir protección frente al desarrollo de sobrepeso u obesidad (y otras complicaciones médicas asociadas) en la edad adulta. El término imprinting, o programación metabólica, describe los procesos por los que las células adquieren una cierta memoria biológica para manejar influencias externas, y que puede ser transmitida a la descendencia celular. Implica que un estímulo que opere en un período crítico o sensible del desarrollo (que podríamos considerar como una ventana específica de sensibilidad) puede dar lugar a efectos persistentes o permanentes sobre la estructura o la función del organismo. La epigenética se refiere a estas alteraciones estables en la expresión génica que no implican mutaciones del DNA en sí mismo pero que confieren un patrón particular de expresión génica que se mantiene estable a lo largo de las divisiones celulares. Se ha considerado que la metilación es la principal base epigenética para la programación metabólica; las histonas, proteínas asociadas íntimamente al DNA, pueden contribuir a estos cambios epigenéticos y la metilación del DNA estaría relacionada con la modificación de histonas. Aunque la leptina es producida principalmente por el tejido adiposo, esta hormona también la producen otros tejidos como la placenta y el músculo esquelético y, en particular, la producen el estómago y el epitelio mamario, y está presente de manera natural en la leche materna. Las concentraciones de leptina en leche materna humana varían perceptiblemente entre unas madres y otras, pero lo que es muy significativo es que las leches artificiales o de fórmula para bebés no contienen leptina como ingrediente. La leche materna es prácticamente el único alimento ingerido durante los primeros meses de la vida en niños alimentados exclusivamente con leche materna y, comparados con la leche de fórmula, los resultados de varios estudios epidemiológicos apuntaban que la lactancia materna confiere una mayor protección frente a la obesidad y otras alteraciones en edad adulta. Se ha mostrado también una correlación inversa entre la duración del amamantamiento y el riesgo de sobrepeso en la edad adulta. Los receptores de leptina están presentes en el estómago humano y en el aparato gastrointestinal del ratón, y la leptina es capaz de activar de manera directa las neuronas aferentes vagales que se originan en las paredes gástricas e intestinales y acaban en el núcleo del tracto solitario, proporcionando una información rápida al cerebro. Por otro lado, se describió que la leptina suministrada con la leche, o administrada por vía oral en solución acuosa, podía ser absorbida por el estómago inmaduro de ratas lactantes y pasar a la circulación sanguínea. Además, la leptina suministrada con la leche materna aparecía como la fuente principal de leptina en el estómago durante la primera mitad de la lactancia. Esta leptina exógena podría ejercer efectos biológicos en recién nacidos, en un período en el que tanto el tejido adiposo como los sistemas reguladores del hambre están inmaduros. Así, nos plantearemos la hipótesis de que la leptina podría ser el compuesto específico (o por lo menos uno de ellos) responsable de los efectos beneficiosos de la leche materna en la protección contra la obesidad en edades más avanzas. Para probarla, suplementamos la lactancia en ratas con dosis fisiológica de leptina por vía oral y observamos los posibles efectos que eso producía sobre la regulación del peso corporal en la edad adulta. Los resultados demostraron que los animales que habían tomado leptina durante la lactancia presentaban en edades adultas menor ganancia de peso y menor acumulación de grasa, e ingerían menos calorías que sus controles no tratados, tanto bajo condiciones de dieta estándar como en condiciones de dieta rica en grasa. La conclusión global de los estudios fue que la suplementación con cantidades fisiológicas de leptina durante la lactancia protege frente a la acumulación de grasa en la edad adulta y que estos animales parecen más sensibles a la regulación de la ingesta por leptina, a corto y a largo plazo. Así pues, la leptina representa un papel importante en las primeras etapas de la vida, como componente de la leche materna, en la prevención de la obesidad en edades más avanzadas. Otros estudios realizados en humanos han confirmado estos resultados y otros sobre la susceptibilidad a otras enfermedades relacionadas con la obesidad. También, los resultados obtenidos en madres no obesas y en sus hijos hasta los dos años de edad indican que la ingesta de más leptina en la leche materna proporciona cierta protección a los niños contra un aumento excesivo del peso. La secuenciación del genoma humano nos ha revelado no sólo un número de genes humanos menor que el esperado (las últimas estimaciones lo calculan en cerca de 24.000 genes), sino también la gran heterogeneidad genética de las poblaciones humanas, una variabilidad genética entre humanos muy superior a la previamente supuesta: se calcula que el genoma humano alberga unos diez millones de polimorfismos. A eso se une la complejidad derivada de las prolijas interacciones entre los genes y su regulación, así como la variabilidad epigenética, el «imprinting metabólico»: nuestra historia de la manera como comemos, como sentimos, las influencias del entorno, etc., va quedando grabada de manera permanente. Todo eso promueve un cambio profundo en el pensamiento humano sobre cómo esta información puede ser explotada óptimamente, en beneficio de la salud y el bienestar. El papel de los polimorfismos genéticos en la determinación de respuestas heterogéneas a exposiciones ambientales como medicinas, actividad física y dieta, es ya evidente. La industria farmacéutica ya explora esta oportunidad a través del desarrollo de la farmacogenómica y, de la misma manera, el sector de la alimentación deberá implicarse en el desarrollo de la nutrigenómica. La oportunidad de desarrollar comercialmente tests nutrigenómicos o nutrigenéticos parece real, de hecho hay un sector creciente de consumidores que ya los demanda y que es capaz de asumir los costes, a pesar de las dudas existentes; por eso los tests a los que puede ya acudir directamente el consumidor son accesibles de manera creciente, aunque consideramos que esta comercialización aún es prematura. BIBLIOGRAFÍA Andreu Palou. Laboratorio de Biología Molecular, Nutrición y Biotecnología. Universitat de les Illes Balears. |
«Actualmente se sabe que algunas enfermedades que se presentan en la edad adulta son el resultado directo del entorno uterino durante el embarazo o de la alimentación durante la lactancia» |
|