El fraude en los ensayos clínicos
El caso Bezwoda y el tratamiento del cáncer de mama
El fraude en la investigación científica es un tema poco comentado, a pesar de su importancia. Más aún si se trata de investigación en temas de salud en los que los resultados de un determinado ensayo clínico pueden suponer un cambio en la forma de abordar ciertas enfermedades.
Algunos casos más llamativos y mediáticos aparecen ocasionalmente en los medios de comunicación, pero este fenómeno requiere de unos mecanismos de control adecuados para minimizarlo o, mejor dicho, evitarlo. Muy cercano tenemos el caso de la bióloga española Susana González, despedida del Centro Nacional de Investigaciones Cardiovasculares en 2016 después de que se retractaran cuatro de sus artículos publicados en Nature y Cell Cycle por presuntas irregularidades en las investigaciones sobre células tumorales y cardíacas. En 2005, el científico estadounidense Eric Poehlman fue condenado por derroche de fondos públicos en sus investigaciones fraudulentas sobre una nueva terapia hormonal sustitutiva en mujeres menopáusicas. De especial relevancia por sus consecuencias en la opinión pública es el ejemplo de la publicación en 1998 del cirujano Andrew Wakefield, que relacionaba de forma engañosa la administración de la vacuna triple vírica con la aparición de autismo.
Un ejemplo quizás menos conocido, pero también de gran impacto, es el de Werner Bezwoda en el tratamiento del cáncer de mama a finales de la década de los noventa. En el presente artículo, además de analizar este caso, nos planteamos cómo detectar las investigaciones basadas en datos fraudulentos. Entre toda la investigación que se publica, ¿cómo podemos saber cuál tiene suficiente evidencia y cuál debe rechazarse?
Buscando la evidencia en medicina
¿Cómo elegir el tratamiento más adecuado en cada momento? Esta es una de las preguntas más importantes, por no decir la pregunta clave, que se puede hacer un profesional sanitario ante un paciente.
Aunque desde la antigüedad se ha considerado el ejercicio de la medicina como una especie de arte, es obvio que se trata de una disciplina científica que debe regirse por normas objetivas y sistemáticas. De esta forma, el principal objetivo de la investigación relacionada con la medicina clínica moderna es racionalizar el conocimiento para predecir situaciones futuras y optimizar las pruebas y los tratamientos a aplicar. En este sentido, desde la mitad del siglo XX se desarrolla y aplica el modelo de medicina basada en la evidencia, que consiste en integrar en la experiencia clínica individual la mejor evidencia proveniente de la investigación científica, tras su revisión crítica y exhaustiva.
Este modelo establece diferentes niveles de evidencia y grados de recomendación de una determinada práctica, según la procedencia de los datos que apoyan a este tipo de tratamiento (Harbour y Miller, 2001). La principal fuente de evidencia son los metanálisis provenientes de las revisiones sistemáticas de un conjunto de ensayos clínicos de alta calidad, es decir, con una metodología correcta y bajo riesgo de sesgo. Por lo tanto, el ensayo clínico se ha convertido en la piedra angular de la investigación en biomedicina. Sin embargo, este método de investigación es una innovación relativamente reciente, posterior a la Segunda Guerra Mundial, y su desarrollo procede de una serie de ajustes ad hoc que han producido un nuevo estilo de práctica todavía abierto y en formación (Cambrosio et al., 2006).
Un ensayo clínico es un estudio de investigación en el que se trata de demostrar qué estrategia de diagnóstico o tratamiento es mejor. Para llevarlo a cabo, deben controlarse el resto de variables para comprobar que el efecto observado es solo debido a la acción experimental. También deben tenerse en cuenta diferentes parámetros estadísticos para asegurar que los resultados no se deben simplemente al azar. En la figura 1 pueden verse las fases de un ensayo clínico por las que debe pasar una molécula o estrategia de tratamiento para llegar a emplearse en la práctica clínica. Cada una de estas fases va dirigida a un grupo de población; tiene una metodología concreta y unos objetivos bien diferenciados.
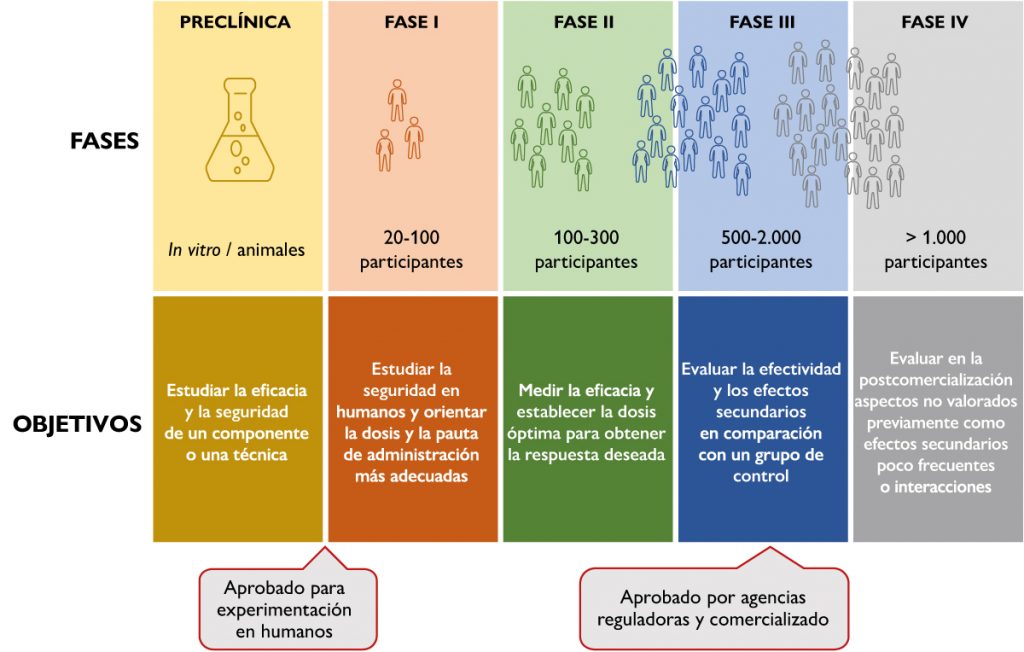
Como cualquier otro tipo de investigación, este modelo de creación de evidencia no está libre de inconvenientes, como pueden ser la posibilidad de errores en el planteamiento y desarrollo del ensayo, así como la interpretación de los resultados en el contexto adecuado. En un paso más allá, estaría también la posibilidad del fraude deliberado por el personal investigador en la fabricación, falsificación o plagio de las ideas.
El cáncer de mama y la quimioterapia a altas dosis
Aunque la supervivencia del cáncer de mama haya mejorado drásticamente desde el inicio de los tratamientos oncológicos, este tipo de tumor es el más frecuente y con mayor mortalidad para la mujer a nivel mundial.
En la década de los setenta se había iniciado el desarrollo de los esquemas de quimioterapia a altas dosis. Esta estrategia de tratamiento condujo a una importante mejora de la supervivencia de algunos cánceres agresivos, como las leucemias, los linfomas de mal pronóstico y algunos tumores infantiles, y ha continuado perfeccionándose hasta la actualidad. Se basa en el aumento de la intensidad de las dosis para destruir un mayor número de células tumorales. Y aunque esto es efectivo, también es un proceso que ocasiona riesgos y en el que el mayor efecto adverso viene determinado por la destrucción masiva de otras células como las de la médula ósea. Esta aplasia medular secundaria debe recuperarse con el trasplante de precursores hematopoyéticos (células madre que dan lugar a los distintos tipos de células sanguíneas: glóbulos rojos, blancos y plaquetas), bien del propio paciente o de una persona donante compatible. Como es de suponer, además de resultar muy tóxico, es extremadamente caro y debe administrarse solo en aquellas situaciones en las que está correctamente indicado.
Durante los años ochenta y noventa se intentó utilizar este tipo de quimioterapia intensiva para los casos de cáncer de mama de peor pronóstico y se llevaron a cabo algunos ensayos de fase II con resultados prometedores comparados con controles históricos. Sin embargo, entre 1993 y 1999 se publicaron cuatro estudios de fase III aleatorizados, los de mayor evidencia científica, que no demostraron diferencias entre la quimioterapia convencional y la de altas dosis en pacientes con cáncer de mama de alto riesgo. A diferencia de estos estudios, en 1995 Werner Bezwoda, jefe del Servicio de Oncología y Hematología del Hospital de Hillbrow (Johannesburgo, Sudáfrica) y profesor del Departamento de Medicina de la Universidad de Witwatersrand, publicó en el Journal of Clinical Oncology el único ensayo de fase III que mostraba resultados positivos para este tipo de quimioterapia en cáncer de mama metastásico (Bezwoda et al., 1995).
Aunque este tratamiento no llegó a estar recogido en ninguna guía de práctica clínica y que la controversia a su alrededor llenó las revistas y debates de las sociedades científicas, durante la década de los noventa, miles de pacientes con cáncer de mama (más de 40.000 solo en EE. UU.) recibieron esta modalidad de quimioterapia con el trasplante posterior de médula ósea en todo el mundo. Esta rápida implantación de un tratamiento experimental es un tema de gran interés, que ha sido estudiado por diferentes autores y en el que entran en juego, por un lado, el desconocimiento de la comunidad científica sobre cuánta evidencia es necesaria y, por otra, las diferentes presiones sociales (que merecerían un artículo aparte).
El caso Bezwoda
En el ensayo clínico liderado por Werner Bezwoda se incluyeron noventa pacientes diagnosticadas de cáncer de mama metastásico: la mitad de ellas recibió un tratamiento estándar y la otra mitad quimioterapia a altas dosis seguida de un trasplante autólogo de médula ósea de rescate.
Los resultados del estudio fueron realmente llamativos, puesto que en el grupo del tratamiento a altas dosis el porcentaje de respuestas tumorales completas, es decir, la desaparición completa del tumor, fue del 51 % frente al 4 % del grupo que recibió un tratamiento convencional. Además, se evidenció una diferencia importante en la duración de la respuesta conseguida y un gran aumento de la supervivencia global con el tratamiento del grupo experimental. Por otra parte, no aparecieron efectos secundarios destacables en el grupo de quimioterapia intensiva —más allá de la aplasia medular esperada— y, sorprendentemente, las muertes debidas al tratamiento fueron más numerosas en el grupo con dosis convencionales. A raíz de los resultados, Bezwoda y sus colaboradores aseguraron haber demostrado que este tratamiento era un esquema válido para determinadas pacientes con cáncer de mama.
La controversia en torno a esta modalidad de quimioterapia tuvo una gran repercusión en la oncología mundial y provocó multitud de debates y publicaciones al respecto (Mello y Brennan, 2001). Tanta fue su importancia y tan contradictorios los resultados de los ensayos publicados hasta el momento que en 1999 se convocó una reunión sobre el tema en el Instituto Nacional del Cáncer de Estados Unidos. Se acordó iniciar un estudio bien diseñado de fase III y de alcance mundial para esclarecer la situación, pero antes se consideró necesario realizar una auditoría sobre los resultados del estudio de Bezwoda, el único discordante y con unos resultados más que asombrosos.
Para llevar a cabo la investigación, se designó a un equipo formado por profesionales de la oncología y la enfermería especialistas en ensayos clínicos, que revisó los datos de las pacientes incluidas en el trabajo de Bezwoda. Este, como jefe del servicio clínico que custodiaba las historias clínicas, no se negó a la realización de la auditoría, pero solo permitió el acceso a los datos originales durante dos días.
Como resultado de la investigación, se descubrió que en el estudio de Bezwoda se habían incumplido algunas de las principales normas recogidas en la declaración de Helsinki y de buena práctica clínica, que son indispensables para iniciar un estudio de estas características con humanos. Entre otras irregularidades, se comprobó que ninguna de las participantes había firmado un consentimiento informado. Además, el protocolo original no se encontró en ninguna parte, y meses después el propio Bezwoda reconoció que el protocolo definitivo fue escrito años después de finalizar el estudio.
El equipo revisor tampoco encontró evidencia de que se hubiera empleado ninguna técnica de aleatorización para asignar a las pacientes a un grupo de tratamiento u otro. Por lo tanto, este proceso estaba totalmente sesgado e invalidaba los resultados finales del estudio. Pero aún se sorprendió más cuando solo pudo encontrar los historiales médicos de sesenta y una de las noventa pacientes incluidas. En este punto es necesario recordar que las normas de buena práctica clínica recomiendan la custodia de los historiales clínicos de las personas participantes en un ensayo clínico alrededor de veinte años, incluso en algunos casos más de veinticinco.
Una vez analizadas las historias clínicas disponibles, solo en la documentación de veintisiete pacientes constaba información suficiente para decidir si eran elegibles para el estudio, y únicamente nueve cumplían todos los criterios de inclusión. Aunque Bezwoda solo reportó una muerte en el grupo de quimioterapia intensiva, en los historiales había evidencia de que tres pacientes recibieron el tratamiento con cifras de plaquetas y hemoglobina muy bajas y sin constancia de ningún control posterior, por lo que se puede suponer que murieron en el medio extrahospitalario y no se registró tal información. Por lo que respecta al seguimiento del resto de las pacientes, solo siete seguían vivas después de 1995 y se perdían todos los seguimientos posteriores. Adicionalmente, un equipo de estadística identificó importantes errores en la codificación de los datos y el análisis presentado en el artículo.

La investigación del caso concluyó que el estudio de Bezwoda no aportaba datos verídicos. La información recogida en la auditoría se publicó en 2000 en la revista The Lancet y en 2001 en Journal of Clinical Oncology junto a una retractación del artículo original.
Ante la sospecha de fraude y con las pruebas de la auditoría, Bezwoda publicó una carta, de la que solo hay algunas referencias, en la que reconocía la situación:
«Yo, W. R. Bezwoda, por la presente reconozco que he cometido una violación grave de la honestidad y la integridad científica en una presentación realizada a la Sociedad Americana de Oncología Médica […] Reconozco mi error y asumo la plena responsabilidad. […] Pido disculpas a la comunidad científica.» (The Cancer Letter, 2000, p. 4)
Posteriormente, Bezwoda fue expulsado de las instituciones donde trabajaba y la Universidad de Witwatersrand publicó un comunicado aclarando que la mala conducta del investigador nada tenía que ver con la institución, la cual colaboró activamente con la auditoría del caso. Los otros dos autores del artículo, Lesley Seymour y Roger Dansey, se mostraron colaboradores con la investigación y reconocieron no conocer ninguna de las irregularidades, dado que ellos no incluyeron pacientes y solo participaron como consultores. Es curioso que la comunidad científica se centró solo en el primer autor, que simplemente desapareció, y olvidó las posibles implicaciones del resto de firmantes que han seguido ejerciendo la oncología y de los que se pueden seguir leyendo artículos publicados en años posteriores. Tampoco debe olvidarse que el artículo pasó el sistema de revisión por parte de una revista muy prestigiosa. Por lo tanto, debemos preguntarnos también si este es un método capaz de detectar la posibilidad de error y fraude o si simplemente debe asumirse la posibilidad de que este tipo de desviaciones puedan pasar desapercibidas. De hecho, recientemente, y a raíz del trabajo retractado en junio de 2020 en el que se señalaba que la hidroxicloroquina no solo no era un tratamiento eficaz frente a la covid-19, sino que agravaba el riesgo de arritmias y muerte intrahospitalaria, The Lancet publicó la modificación de su metodología de revisión de artículos. De esta forma, en aquellos estudios con un gran volumen de datos al menos uno de los revisores debe ser especialista en ciencia de datos y debe tener acceso a la información original para analizarla como una parte más del proceso de edición.
Posibilidad de error y fraude científico
La honestidad y veracidad son principios fundamentales de la investigación científica y la adhesión a estos principios es esencial tanto para el progreso de la ciencia como para la percepción pública del trabajo científico y de sus resultados. El incumplimiento de estos principios está considerado como mala conducta científica o fraude, que no es lo mismo que un error.
De forma simplificada, lo que tiene que ver con un mal planteamiento, medida o análisis de los datos a estudio se llama error. Pero lo que se considera mala conducta o fraude tiene otra implicación. Como dice el Código Federal de Regulaciones estadounidense:
«Las malas conductas en investigación incluyen la fabricación, la falsificación y el plagio tanto al proponer, realizar o revisar la investigación como en la forma de dar a conocer los resultados. […] La mala conducta o fraude en la investigación no incluye el error involuntario o las diferencias de opinión.» (Federal Register, 2005, 70(94), p. 28386)
Este último punto es crucial, puesto que la diferencia entre un error y un fraude es la intencionalidad de engañar.
Las razones para cometer fraude en investigación clínica varían mucho de un caso a otro. El fraude puede deberse a la ambición de prestigio, a intereses financieros o a las dificultades para llevar a cabo estudios complicados a pesar de saber que el centro donde se llevan a cabo no está capacitado para ello. En el caso Bezwoda, ¿cuál era realmente su intención? ¿Podría ser fruto de un intento demasiado exagerado de que los resultados cuadraran con lo que quería que fuera la conclusión? ¿Podría haber pasado este caso más desapercibido si los resultados no hubieran sido tan espectaculares? ¿Hasta qué punto el maquillaje o procesamiento de los datos es frecuente a menor escala? ¿Y cuáles deben ser las consecuencias para la persona que comete fraude?
¿Es posible el control absoluto?
Como hemos visto, este modelo de evidencia está ampliamente aceptado por la comunidad científica, pero, como cualquier otro, no está libre de problemas. Lo que debemos plantearnos es de qué forma podemos intentar disminuir las posibilidades de error y mejorar los mecanismos de control para evitar los errores cometidos de forma deliberada.
De entrada, sería conveniente medir con qué frecuencia se producen los diferentes tipos de error y fraude, y cuál es su magnitud, aunque esto es muy difícil de cuantificar de forma real.
Por último, cabe destacar que, al margen de los problemas ya conocidos, al tiempo que evoluciona la investigación se descubren nuevas necesidades y puntos débiles para los que deben proponerse mecanismos reguladores. Es cierto que no se busca sustituir el ensayo clínico, pero sí opciones que complementan y controlan la forma de llegar a la deseada evidencia.
Referencias
Bezwoda, W. R., Seymour, L., & Dansey, R. D. (1995). High-dose chemotherapy with hematopoietic rescue as primary treatment for metastatic breast cancer: A randomized trial. Journal of Clinical Oncology, 13(10), 24839. https://doi.org/10.1200/JCO.1995.13.10.2483 (retractación publicada el de junio de 2001, en Journal of Clinical Oncology, 19[11], 2973).
Cambrosio, A., Keating, P., Schlicha, T., & Weisza, G. (2006). Regulatory objectivity and the generation and management of evidence in medicine. Social Science & Medicine, 63, 189–199. https://doi.org/10.1016/j.socscimed.
2005.12.007
Federal Register. (2005). Public Health service policies on research misconduct. U. S. Department of Health and Human Services. Federal Register, 70(94), 28386. https://www.govinfo.gov/content/pkg/FR-2005-05-17/pdf/05-9643.pdf
Harbour, R., & Miller, J. (2001). A new system for grading recommendations in evidence based guidelines. BMJ, 323(7308), 334–336. https://doi.org/10.1136/bmj.323.7308.334
Mello, M., & Brennan, T. A. (2001). The controversy over high-dose chemotherapy with autologus bone marrow transplant for breast cancer. Health Affairs, 20(5), 101–117. https://doi.org/10.1377/hlthaff.20.5.101
The Cancer Letter. (2000). South African investigator Bezwoda admits falsifying data in high-dose chemo study. The Cancer Letter, 26, 1–4. https://cancerletter.com/the-cancer-letter/20000211_1