Cáncer hereditario
Importancia y necesidad de detectarlo

RESUMEN
A pesar de que tan solo el 1% de los casos de cáncer se pueden considerar de tipo hereditario, en la actualidad se han descrito más de 200 síndromes caracterizados por la agregación familiar de distintos tipos de tumores. La identificación a lo largo del siglo xx de muchos de los genes responsables de estos síndromes ha permitido un gran avance en el manejo de estas familias a la hora de identificar o descartar los individuos en riesgo y establecer medidas preventivas específicas. Sin embargo, existe todavía un alto porcentaje de casos hereditarios en los que la causa de la susceptibilidad es desconocida, lo que hace de la búsqueda de nuevos genes mediante las nuevas tecnologías una de las prioridades en investigación.
Palabras clave: cáncer hereditario, modelos de herencia, BRCA1, BRCA2, síndrome de cáncer de mama y ovario hereditario.
INTRODUCCIÓN HISTÓRICA
A día de hoy se han identificado más de 200 síndromes hereditarios asociados con un incremento en el riesgo de cáncer, caracterizados por la aparición de neoplasias malignas primarias en múltiples miembros de una familia y que en algunos casos se asocian con anomalías congénitas. Fue precisamente la observación de agrupaciones familiares de estas anomalías congénitas lo que llevó a observar también los primeros casos de cáncer hereditario. Entre estos primeros se encuentran los casos de neurofibromatosis tipo 1 (NF1), caracterizados por la presencia de alteraciones cutáneas, como las «manchas café con leche» y nódulos pequeños en la piel, además de un riesgo incrementado al desarrollo de tumores del sistema nervioso central.
En 1866, el cirujano francés Paul Broca publicó por primera vez un ejemplo de cáncer de mama hereditario en el que describía cuatro generaciones de mujeres afectadas de cáncer de mama en la familia de su mujer. A lo largo del siglo xx se realizaron numerosas descripciones clínicas de agrupaciones familiares de cáncer, sin embargo fueron la teoría de Knudson a principios de los años setenta (Knudson, 1971), junto con el descubrimiento en el año 1986 del primer gen de susceptibilidad al cáncer, Rb, implicado en el retinoblastoma familiar (Friend et al., 1986), los dos hitos que marcaron una nueva era en el campo del cáncer hereditario.

Imágenes de la serie «David contra Goliat», donde el fotógrafo Tino Soriano continúa reflejando el cáncer, en concreto el infantil. En la imagen, Hospital de Sant Pau de Barcelona. / Foto: Tino Soriano
La teoría de Knudson se basó en la observación de 48 casos de retinoblastoma, un tumor maligno de retina. En el año 1971, Knudson desarrolló su teoría de two-hits, basándose en la observación de que los casos de retinoblastoma hereditario presentaban una edad de aparición mucho más temprana que los casos esporádicos (casos únicos sin antecedentes familiares). Según la hipótesis de Knudson, la enfermedad está causada por dos eventos mutacionales, two-hits, que afectarían a las dos copias del gen causante de la enfermedad. En la forma hereditaria, una mutación (alteración en la información genética) se encontraría en la línea germinal, transmitiéndose de generación en generación y confiriendo a los portadores una susceptibilidad muy alta a padecer el cáncer. Esta susceptibilidad se heredaría de forma autosómica dominante, es decir, un gen anormal de uno de los padres sería suficiente para causar la susceptibilidad a sufrir la enfermedad, aunque la segunda copia del gen del otro progenitor fuera normal. La segunda copia se alteraría a nivel somático, en este caso la retina, y es entonces cuando se produciría el tumor (figura 1). En las formas no hereditarias, ambas mutaciones ocurrirían a nivel somático.
Poco después se publicó que este modelo sería extensible al tumor de Wilms (tumor renal en la infancia), al neuroblastoma en la infancia (tumor embrionario del sistema nervioso), al feocromocitoma (tumor de la glándula suprarrenal) y, en general, a todos los cánceres hereditarios. Esta teoría se ha mantenido hasta la actualidad y, aunque hay excepciones, la mayoría de los principales síndromes de cáncer hereditario siguen este patrón.
PRINCIPALES GENES IMPLICADOS: MODELOS DE HERENCIA
Hasta finales del siglo xx, la investigación sobre la susceptibilidad heredada a padecer cáncer estuvo centrada en la identificación de este tipo de genes de alta penetrancia o alta susceptibilidad. Ejemplos clásicos de genes, además de los ya mencionados, son el gen TP53, identificado en el año 1990 y responsable del síndrome de Li-Fraumeni; el gen APC, en el año 1991, y responsable del cáncer de colon polipósico familiar o el gen MSH2, en 1993, implicado en el cáncer de colon no polipósico hereditario. El año 1994 fue especialmente fructífero, ya que se identificaron tres de los genes más importantes, MLH1, segundo gen implicado en el cáncer de colon no polipósico, BRCA1, primer gen implicado en el síndrome de cáncer de mama y ovario hereditario (CMOH), y p16, implicado en el melanoma familiar. Estos son algunos de los más importantes. Destaca por último el descubrimiento en 1995 de BRCA2, el segundo gen de susceptibilidad para cáncer de mama y ovario, ya que utilizaremos el ejemplo de este síndrome para introducir otros conceptos en este artículo.
«En 1866, el cirujano francés Paul Broca publicó por primera vez un ejemplo de cáncer de mama hereditario en el que describía cuatro generaciones de mujeres afectadas de cáncer de mama»
El origen del cáncer reside en la capacidad que adquieren ciertas células para escapar de los mecanismos que regulan el crecimiento celular normal, llegando así a proliferar de una forma descontrolada. Todos los genes mencionados hasta ahora, y la mayoría de los implicados en cáncer hereditario, son los denominados genes supresores de tumores (GST). En general la función de estos genes es controlar de forma negativa el ciclo celular, impidiendo esta proliferación descontrolada de células. Existen algunas excepciones a esta regla, en las que el gen implicado no es un GST sino un protoncogén, es decir, un gen cuya función es la activación del crecimiento y la división celular. Un ejemplo de este tipo de genes es el protoncogén RET, implicado en la neoplasia endocrina múltiple tipo 2 (MEN2). La diferencia con los GST reside en que su papel es activador del ciclo celular y que sufren mutaciones activadoras de función, por lo cual solamente es necesario que esté alterada una copia del gen para que se produzca el tumor.
En todos los casos mencionados hasta ahora, el patrón de herencia es autosómico dominante, sin embargo es obligado mencionar algunos síndromes de cáncer hereditario que siguen un modelo autosómico recesivo. En estos casos, las dos copias del gen tienen que estar mutadas a nivel germinal para que se desarrolle la enfermedad. La mayoría de los genes implicados en estos síndromes actúan en procesos de reparación del ADN, lo cual es la causa de que la inestabilidad cromosómica sea una característica común a estos. Un ejemplo muy significativo es la anemia de Fanconi (AF), una enfermedad que se caracteriza por fallo medular progresivo, hipersensibilidad a agentes intercalantes del ADN (moléculas que se intercalan en las bases que conforman el ADN y que afectan a su estructura) y susceptibilidad incrementada a padecer cáncer.
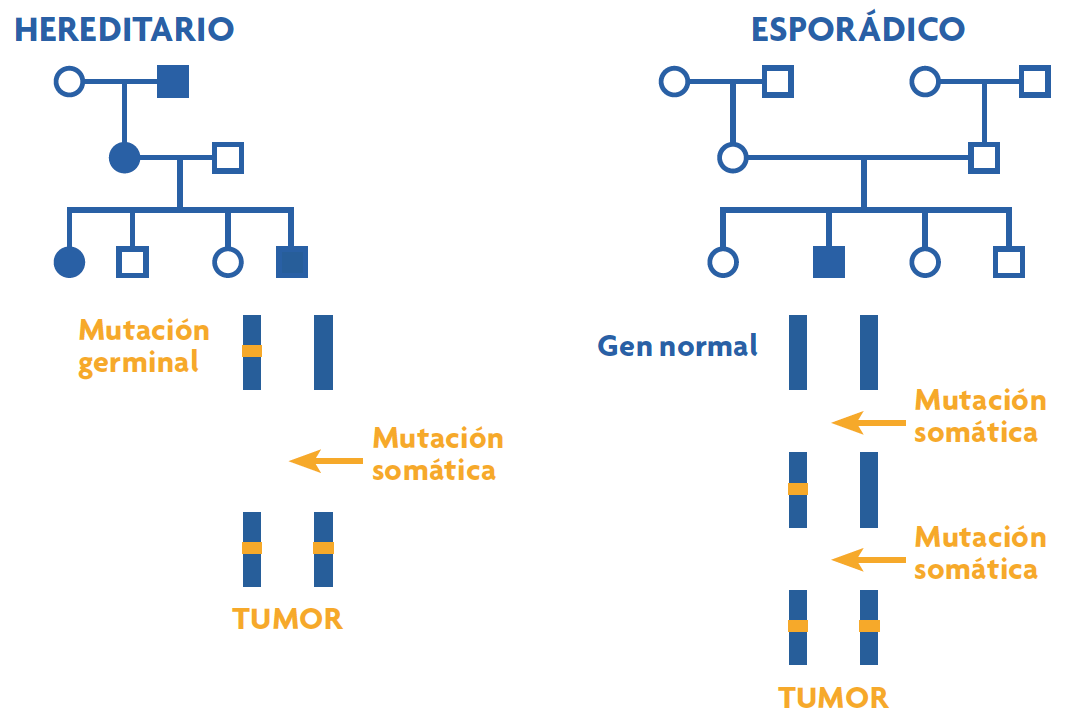
Figura 1. Modelo de two-hits de Knudson.Se presentan dos árboles genealógicos en los que los círculos representan mujeres y los cuadrados, varones; se representan en color azul los individuos diagnosticados de cáncer. En el caso hereditario (a la izquierda), una de las copias del gen responsable de la enfermedad ya está alterada en línea germinal, esto hace que el evento de una segunda mutación somática sea muy probable y por tanto el riesgo de desarrollo del cáncer sea muy alto y la edad de aparición más temprana. En el caso esporádico (a la derecha) ambas mutaciones tienen que ocurrir a nivel somático, suceso mucho más improbable y que explica por qué en esta familia hay un solo caso de cáncer y la edad de aparición es más tardía. / Ana Osorio
MANEJO CLÍNICO DE LAS FAMILIAS CON CÁNCER HEREDITARIO
Es necesario puntualizar que estos que podemos considerar como claramente hereditarios, globalmente tan solo representan el 1% de los casos de cáncer, que la mayor parte de las veces aparecen de forma esporádica y que en su etiología participan multitud de factores.
Sin embargo, aunque beneficia a un porcentaje pequeño de los casos, la identificación de estos genes de alto riesgo ha representado un gran avance en el manejo de las familias con cáncer hereditario, ya que ofrece la posibilidad de realizar un test genético mediante el que identificar y descartar a los individuos en riesgo. Actualmente la única opción que existe para curar a un paciente de cáncer es una detección temprana o bien la prevención. En este sentido, la posibilidad de identificar en una familia con cáncer hereditario cuál es la causa de la susceptibilidad permite hacer un seguimiento personalizado de aquellos miembros de la familia que son portadores de una mutación concreta y que sabemos positivamente que tienen un riesgo muy alto de desarrollar un cáncer a lo largo de su vida.

Figura 2. Ejemplo de una familia con cáncer de mama hereditario, portadora de mutación germinal en el gen BRCA1. Se observan características que son comunes a la mayoría de los cánceres familiares, entre otras: un elevado número de personas afectadas en la familia, una edad de aparición de los tumores más temprana que la edad media de diagnóstico del tumor en la población general, presencia de bilateralidad en caso de que el cáncer afecte a órganos pares y presencia de otros tumores asociados, como en este caso, cáncer de ovario. / Ana Osorio
Tomemos como ejemplo la familia con cáncer de mama y ovario hereditario representada en la figura 2. Una vez detectada la mutación en BRCA1 responsable de la susceptibilidad, es posible realizar el test genético en todas aquellas mujeres de la familia que no han desarrollado cáncer. Las que resulten portadoras, y por lo tanto tengan un riesgo elevado, podrán ser sometidas a programas de seguimiento personalizados que permitirán detectar el tumor en una fase muy temprana en la que será curable con una alta probabilidad. En estas mujeres en riesgo, dependiendo de las circunstancias personales, existe incluso la posibilidad de realizar una cirugía profiláctica que reduzca la posibilidad de padecer cáncer de mama u ovario hasta en un 95%. Dependiendo del tipo de tumor hereditario, la detección de la alteración responsable de la susceptibilidad permite tomar medidas más o menos efectivas.
Por ejemplo, el síndrome de MEN2A se caracteriza por la aparición de tumores endocrinos, en particular carcinoma medular de tiroides, feocromocitoma e hiperplasia de paratiroides, y es causado en la mayoría de los casos por mutaciones heredadas en el protoncogén RET mencionado previamente en este artículo. La naturaleza de este gen hace que los individuos portadores de mutaciones desarrollen un tumor en el 100% de los casos, ya que solamente es necesario que una copia del gen esté alterada, lo que representa una excepción al modelo de two-hits de Knudson. La medida principal de intervención preventiva primaria es una tiroidectomía profiláctica en edad infantil que elimina por completo el riesgo de desarrollar carcinoma medular de tiroides.
En el extremo opuesto se encuentran los síndromes asociados con la aparición de múltiples tumores, como el de Li-Fraumeni, caracterizado por la aparición de sarcomas de partes blandas, osteosarcomas, cáncer de mama, tumores cerebrales y leucemia. En este síndrome el seguimiento de los pacientes es mucho más complicado, no solo por la posibilidad de desarrollar tumores distintos sino porque algunos de ellos son muy difíciles de diagnosticar precozmente.
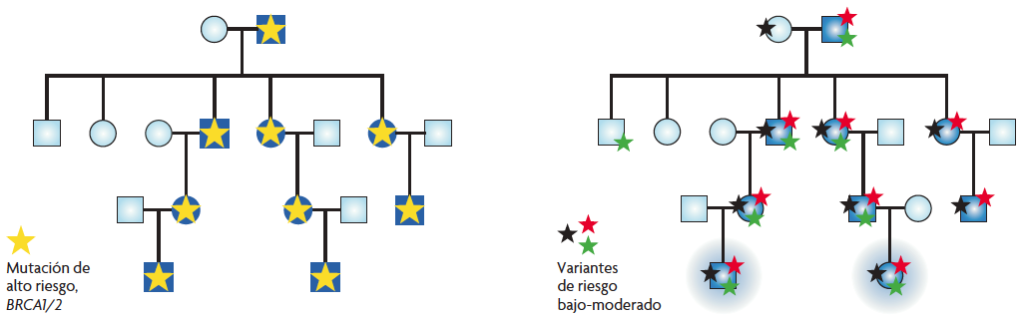
Figura 3.El árbol genealógico de la izquierda representa un caso clásico de cáncer hereditario en el que todos los individuos afectados de la familia (en azul) se explican por una mutación en un gen de alto riesgo (estrella amarilla). La genealogía de la derecha representa la misma familia, pero esta vez, los casos de cáncer se explican por la acumulación y combinación de variantes de bajo y/o moderado riesgo. Solo los casos en los que se acumula un número suficiente de variantes llegarán a desarrollar cáncer, mientras que los individuos que presenten una sola variante no lo desarrollarán, ya que el riesgo que estas confieren es muy bajo a nivel individual. / Ana Osorio
OTROS GENES DE SUSCEPTIBILIDAD
Uno de los principales problemas que se presentan cuando estamos frente a un caso de cáncer hereditario es la no detección de la alteración causante de la susceptibilidad. En la mayoría de los síndromes de cáncer hereditario, existe un porcentaje de los casos que no se explican por mutaciones en los genes conocidos, uno de los ejemplos más representativos de este problema es el síndrome de CMOH.
«El origen del cáncer reside en la capacidad que adquieren ciertas células para escapar de los mecanismos que regulan el crecimiento celular normal, llegando así a proliferar de una forma descontrolada»
Cuando se identificaron los genes BRCA1 y BRCA2 hace casi veinte años, se pensó que las mutaciones germinales en estos podrían explicar hasta el 80% de los casos de cáncer de mama hereditario, sin embargo pocos años después se confirmó que este porcentaje no era tan alto y que podía ser variable según la población analizada. Actualmente se considera que en general estos dos genes no explican más de un 20% de los casos, lo que ha motivado que en los últimos diez años la búsqueda de nuevos genes de susceptibilidad haya sido uno de los principales objetivos de los grupos de investigación. Sin embargo, desde los años noventa no se ha identificado ningún otro gen de alto riesgo específicamente implicado en el síndrome. Esto ha llevado a la aceptación del modelo poligénico, que explicaría el incremento en el riesgo y la agrupación familiar, por la combinación de variantes de riesgo bajo o moderado que se acumularían en estas familias (figura 3)..
A nivel individual, cada variante modificaría muy poco el riesgo, pero en unión con otros factores, tanto genéticos como ambientales, estos genes de baja o moderada penetrancia no solo estarían implicados en estos patrones familiares, sino que serían responsables de las diferencias en la susceptibilidad a padecer cáncer que existen entre los individuos de la población general. En los últimos cinco años se ha producido un gran avance en el descubrimiento de algunas de estas variantes a través de los estudios de asociación de genoma completo, conocidos comúnmente como GWAS (Genome Wide Association Studies) (Visscher, 2012). Este modelo se está aplicando también a otros tipos de cáncer hereditario.
Bibliografía
Cirulli, E. T. y D. B. Goldstein, 2010. «Uncovering the Roles of Rare Variants in Common Disease Through Whole-genome Sequencing». Nature Reviews Genetics, 11: 415-425. DOI: <10.1038/nrg2779>.
Friend, S. H. et al., 1986. «A Human DNA Segment with Properties of the Gene that Predisposes to Retinoblastoma and Osteosarcoma». Nature, 323: 643-646. DOI: <10.1038/323643a0>.
Knudson Jr., A. G., 1971. «Mutation and Cancer: Statistical Study of Retinoblastoma». PNAS, Proceedings of the National Academy of Sciences, 68(4): 820-823. DOI: <10.1073/pnas.68.4.820>.
Ponder, B. A.; Antoniou, A.; Dunning, A.; Easton, D. F. y P. D. Pharoah, 2005. «Polygenic Inherited Predisposition to Breast Cancer». Cold Spring Harbor Symposia Quantitative Biology, 70: 35-41. DOI: <10.1101/sqb.2005.70.029>.
Visscher, P. M.; Brown, M. A.; McCarthy, M. I. y J. Yang, 2012. «Five Years of GWAS Discovery». The American Journal of Human Genetics, 90: 7-24. DOI: <10.1016/j.ajhg.2011.11.029>.





