Genes arquitectos del cerebro
La evolución cerebral a través de la genoarquitectura
El cerebro de los humanos modernos es el resultado de la evolución de un plan de construcción (Bauplan) que comienza a diseñarse hace 500 millones de años. Fue un proceso iniciado en los cordados basales (animales marinos que vivían inmersos en la arena) que dio origen al primer plan de construcción del sistema nervioso central; este se modificó progresivamente y fue compartido por todos los vertebrados. Detrás de este proceso están las redes génicas, actores clave para dar identidad a las distintas regiones del cerebro. Este escenario evolutivo proporciona la base para los estudios que tratan de entender lo que se «conserva» y lo que es «nuevo» entre distintos vertebrados, así como también de los mecanismos subyacentes implicados en este proceso. Este artículo explora el papel de los estudios genoarquitectónicos en esta aventura científica.
Palabras clave: evolución del cerebro, patrones de expresión génica, regionalización cerebral, redes génicas.
¿Es el cerebro humano diferente al de un tiburón, un pollo o un chimpancé?
Todos los vertebrados tienen un origen evolutivo común, es decir que tienen un ancestro común. Uno de los principales pasos en el largo camino para producir el cerebro de los vertebrados actuales era obtener un plan de diseño básico para ser utilizado en la construcción del cerebro. Una forma de comprender el significado de este plan de construcción es compararlo con los planos de una casa. Desde el comienzo de la evolución cultural de la humanidad, el modelo de casa se ha modificado desde un único compartimento para usos múltiples, hasta el modelo actual que tiene distintas «partes» como la cocina, el dormitorio, el baño y la sala de estar. Estas «partes» se fueron agregando según necesidades propias de cada época; por ejemplo, un aparcamiento en etapas más recientes. Sin embargo, todas las casas tienen los mismos espacios básicos. Algo similar ocurrió con la evolución del cerebro de los vertebrados. Los cordados basales de hace 500 millones de años dieron origen a un sistema nervioso central relativamente simple con pocos compartimentos; este modelo fue modificado cuando surgieron los vertebrados. Lo que llevó al desarrollo de un mayor número de regiones.
«¿Cómo sabemos si una estructura anatómica es distinta de otra? Es algo que parece sencillo, y sin embargo no resulta tarea fácil»
Diversos estudios experimentales han demostrado que el cerebro de todos los vertebrados parte de un plan general que se establece temprano durante el desarrollo. Lo primero que ocurre durante la formación del sistema nervioso central es la generación de un tubo neural a partir de una lámina de células conocida como placa neural. Este proceso en el ser humano acontece durante la tercera y cuarta semana de desarrollo embrionario. A partir de este momento la placa y el tubo empiezan a «regionalizarse» tanto en su dimensión rostrocaudal (anteroposterior) como en la dorsoventral (es decir, en torno a la circunferencia del tubo) (Nieuwenhuys, Voogd y Van Huijzen, 2008). De esta forma se producirán desde la parte más rostral a la caudal del tubo neural las diferentes regiones que constituyen el sistema nervioso central. La parte más rostral del tubo produce el cerebro anterior o prosencéfalo, que da lugar al hipotálamo y al telencéfalo (que incluye la corteza cerebral) en su parte rostral, y al diencéfalo caudalmente (que produce el pretálamo, tálamo y pretecho). Caudalmente al prosencéfalo encontramos el cerebro medio o mesencéfalo, el cerebro otras estructuras) y la médula espinal (figuras 1 y 2).
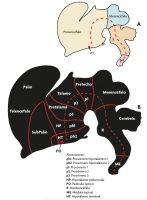
Figura 1. Esquemas de una vista lateral del sistema nervioso central en los que se indican algunas de las principales regiones compartidas por todos los vertebrados (Bauplan común). A) Durante la regionalización del tubo neural se formarán las regiones prosencefálica (o cerebro anterior, que contiene el prosencéfalo secundario y el diencéfalo), mesencefálica (o cerebro medio), rombencefálica (o cerebro posterior) y la médula espinal. B) En la región más rostral, el prosencéfalo secundario está formado por dos prosómeros (ph1 y ph2) que darán origen al hipotálamo, y dorsalmente formarán el telencéfalo. Caudalmente al prosencéfalo secundario se localiza el diencéfalo, que contiene los prosómeros 1 (pretectum o pretecho), 2 (tálamo) y 3 (pretálamo), seguido del mesencéfalo (con dos neurómeros aquí no indicados), el rombencéfalo (con once neuromeros no indicados) y la médula espinal. Debido al crecimiento diferencial de las distintas regiones, el eje longitudinal del tubo neural se curva (la línea roja discontinua separa las partes dorsal y ventral del cerebro y sirve como guía para ver la orientación del eje). Hay que destacar que la mayor parte del telencéfalo (palio y subpalio) corresponde a la extensión dorsal del neurómero ph1. / José Luis Ferran
Hoy en día sabemos que estas regiones contienen compartimentos anteroposteriores más pequeños que funcionan como bloques de construcción, conocidos como neurómeros; por ejemplo, el prosencéfalo incluye cinco neurómeros: dos más rostrales que dan lugar al hipotálamo y al telencéfalo; y tres más caudales que dan lugar a distintas partes del diencéfalo (figura 1). A su vez, cada neurómero se subdivide en compartimentos más pequeños a lo largo del eje dorsoventral. Los detalles de cómo se regionaliza el cerebro de vertebrados se abordan con precisión en el modelo prosomérico propuesto por Puelles y Rubenstein (2003, 2015). Según este modelo, estos compartimentos fundamentales se encuentran en todos los vertebrados y se establecen durante su desarrollo embrionario temprano; por tanto, representan las unidades de desarrollo que forman parte del plan de construcción del sistema nervioso central de los vertebrados. Esto significa que vamos a encontrar los mismos compartimentos generales (los mismos neurómeros y sus subdivisiones dorsoventrales) tanto en cocodrilos, patos, elefantes como en humanos.
Ahora bien, si los compartimentos son los mismos, ¿en qué difieren estos cerebros entre sí? La principal diferencia reside en los derivados que cada uno de ellos puede dar. Uno de los ejemplos más interesantes corresponde a la corteza cerebral, una parte del telencéfalo muy expandida en muchos mamíferos (figura 2), pero con una organización muy diferente en no-mamíferos. Esto significa que un determinado compartimento puede producir estructuras diferentes en tamaño y morfología en aves y mamíferos. De hecho, actualmente aún se discute exactamente cuál es la región comparable (homóloga) a la corteza cerebral de mamíferos en aves y reptiles. Por otra parte, cuando se compara la corteza cerebral de diferentes mamíferos, como roedores, gatos, chimpancés y humanos, resultan evidentes las diferencias de tamaño, y destaca su mayor extensión en primates y, en particular, en humanos.
En conclusión, si bien todos los vertebrados tenemos el mismo plan de construcción del cerebro, cada especie ha podido variar el tamaño de las divisiones de este órgano e incluso producir «nuevos» derivados. Retomando el ejemplo de las partes básicas de una casa: todas las viviendas tienen cocina pero esta no es igual en todos los hogares, porque no todas las familias tienen las mismas necesidades; lo mismo se aplica al cerebro comparado entre los distintos vertebrados. Las mismas partes están presentes en todos, pero puede cambiar el tamaño, el número o el tipo de derivado que encontramos en cada región, o incluso su localización (si ha habido alguna variación en la migración de las neuronas producidas en cada compartimento durante el desarrollo). La pregunta que en este punto deberíamos hacernos es: ¿cómo se ha llegado a estas conclusiones? O dicho con otras palabras, ¿cuales son las estrategias de investigación que permiten acercarnos a esta idea? Aquí es donde los genes empiezan a tomar un rol protagonista, y para estudiarlos los investigadores actúan como detectives para intentar conocer lo que podría haber acontecido durante la evolución del cerebro.
¿Cuál es el papel de los genes en el desarrollo del cerebro?
Los genes, cuando están activos, sintetizan moléculas de ARN (mediante un proceso conocido como transcripción) que luego se utilizan para producir una proteína (a través del mecanismo denominado traducción). Esta última molécula es la que finalmente ejerce distintas funciones, como las relacionadas con el mantenimiento de la célula, la especificación de la identidad celular durante el desarrollo, el aumento del número de células (proliferación), los cambios en la adhesividad, etc. La actividad de un gen es controlada por regiones de ADN cuya función es regular la expresión génica. Estas zonas reguladoras determinarán cuándo y dónde se expresará un gen, activando o reprimiendo a las regiones promotoras que dan inicio a la transcripción. Algunos genes tienen como función primordial regular la expresión de otros. Sus productos proteicos, que se conocen como factores de transcripción, se transportan al núcleo e interactúan con las regiones reguladoras que controlan la expresión de otros genes. La activación de un gen suele requerir de un grupo de productos proteicos de otros genes; además, en algunos casos, su propia activación puede conducir a activar o reprimir la expresión de otros genes. Aunque presentado aquí de forma simplificada, este modelo de funcionamiento en el que varios productos génicos (proteínas) pueden interactuar y determinar la expresión de otros genes, es subyacente a cómo funciona una red génica (Davidson, 2006; Puelles y Ferran, 2012).
«La genoarquitectura neural hace referencia a la descripción de las estructuras neurales en términos de patrones de expresión génica, e implica el uso de las sondas de ARNm como marcadores morfológicos»
Durante el desarrollo del cerebro, el tubo neural va dividiéndose en compartimentos que adquieren una identidad propia debido a la participación de redes génicas que se activan de forma diferencial en el espacio (dando lugar a distintas regiones) y en el tiempo (en cada momento del desarrollo). Los derivados anatómicos que se originan progresivamente a partir de cada compartimento estarán estrechamente relacionados con los efectos de estas redes génicas. Ahora bien, el número de genes que poseemos los humanos no es infinito y ronda unos 20.000. La mayor parte de ellos son utilizados en el cerebro, ya sea en su construcción o en su funcionamiento. Considerando la gran diversidad de procesos de regionalización y especificación desde que comienza a formarse el organismo y la gran variedad de tipos celulares que posee cada órgano, este número de genes es muy bajo como para asociar un gen a una función. Un producto génico suele utilizarse tanto en el desarrollo como en la vida postnatal en multiplicidad de eventos. Es el contexto en el que se expresan, es decir, con que otros genes interactúan y la historia molecular previa de la región, lo que determinará su efecto final en el órgano. Por tanto, lo importante en este proceso son las redes de expresión de genes.
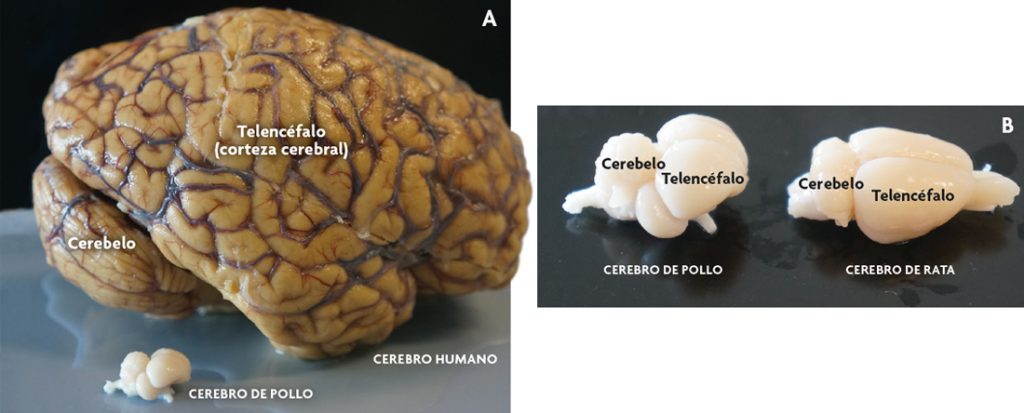
Figura 2. Sistema nervioso central de mamíferos y aves. A) Fotografía comparando un cerebro humano con uno de pollo. Hay que destacar el tamaño de la corteza cerebral humana. B) Vista de un cerebro de pollo de un mes de vida postnatal y de un cerebro de rata de dos meses y medio de vida postnatal (adulto joven). En el roedor la corteza cerebral también está expandida, pero a diferencia del humano no presenta pliegues. Sin embargo, en el pollo el telencéfalo corresponde en su mayor parte a estructuras diferentes a la corteza cerebral (actualmente todavía se discute cual es la región homóloga a la corteza cerebral en aves). En todos los casos se destaca el cerebelo (parte del cerebro posterior o rombencéfalo). / José Luis Ferran
Uno de los acontecimientos clave en la evolución de los vertebrados y específicamente del sistema nervioso central fue una doble ronda de duplicación del genoma entero que ocurrió en los ancestros de los vertebrados.. Susumu Ohno (1970) propuso la denominada teoría de la doble duplicación genómica (hipótesis 2R) como acontecimiento clave en el origen de los vertebrados. Esta propuesta ha sido refrendada por los resultados del análisis de secuencias genómicas completas de diferentes vertebrados y de cordados basales como el del actual anfioxo (Putman et al., 2008). Como consecuencia de estas duplicaciones, los vertebrados podrían tener potencialmente cuatro copias de cada gen. Esta redundancia de información permitió por un lado que se conservaran funciones iniciales, y por otro que se generaran nuevas o se separaran funciones entre los «nuevos» genes. Aún cuando se han perdido muchos genes producto de esa duplicación como resultado del proceso evolutivo, actualmente el genoma de aves y de mamíferos tiene más de una copia para muchos de sus genes. Algunos peces teleósteos y especies de anfibios del género Xenopus tienen rondas adicionales de duplicaciones genómicas. La doble duplicación genómica no fue el único mecanismo que incrementó el número de genes durante estos 500 millones de años, sino que además en muchos casos los genes se duplicaron individualmente y alinearon uno tras otro. El aumento del número de genes fue paralelo al aumento de complejidad de los organismos y en el caso del sistema nervioso central podemos encontrar un plan de construcción más complejo en vertebrados que el observado en cordados basales.
«La genoarquitectura permite obtener detalles sobre el origen durante el desarrollo y la evolución de los distintos grupos de neuronas del cerebro no imaginables décadas atrás»
Los genes trabajan en red y en localizaciones anatómicas específicas; están implicados en distintas funciones dependiendo del contexto. Si el plan de formación del sistema nervioso central se conserva o se comparte entre vertebrados, esperaríamos encontrar redes génicas muy similares funcionando en la misma región del cerebro de distintos vertebrados. No obstante, también hay que considerar que, en algunos casos, en una determinada localización estas redes podrían haber cambiado de forma significativa durante la evolución. Como analizaremos en el próximo apartado, los productos génicos que actúan en etapas tempranas del desarrollo y participan en la especificación de la identidad de una región o de sus derivados resultan de utilidad para estudios comparados, pues permiten reconocer qué componentes se originan a partir de la misma región en las distintas especies.
La genoarquitectura ayuda a entender la evolución del cerebro
¿Cómo sabemos si una estructura anatómica es distinta de otra? Algo que parece sencillo, sin embargo no resulta una tarea fácil. Si lo que queremos es saber cómo reconocer una estructura anatómica con respecto a otra, requerimos de herramientas potentes que indiquen claramente la extensión de un territorio (sus límites o bordes), o la identidad común que puede tener un grupo de células. Como hemos explicado previamente, detrás del establecimiento de un plan de formación del cerebro y de la generación de derivados específicos están los genes. Por lo tanto, si logramos determinar qué genes están activos en cada territorio durante el desarrollo, podríamos caracterizar los límites entre ellos y además definir cuántos componentes diferentes se originan a partir de cada región con gran precisión. Los estudios de la genoarquitectura neural hacen referencia a las descripciones de la estructura neural en términos de patrones de expresión génica definidos. Ya sabemos que la identidad de un territorio la dan las redes génicas que se están expresando en una posición y momento determinados durante el desarrollo. Por lo tanto, la estrategia es localizar en la zona de interés el ARN mensajero (ARNm), que es el producto de la transcripción de un gen activo, mediante la técnica de hibridación in situ (figura 3). De esta forma, la genoarquitectura neural hace referencia a la descripción de las estructuras neurales en términos de patrones de expresión génica, e implica el uso de las sondas de ARNm como marcadores morfológicos. Estos estudios genoarquitectónicos permiten una discriminación morfológica que está revolucionando la neuroanatomía moderna (Puelles y Ferran, 2012; Ferran et al., 2015).
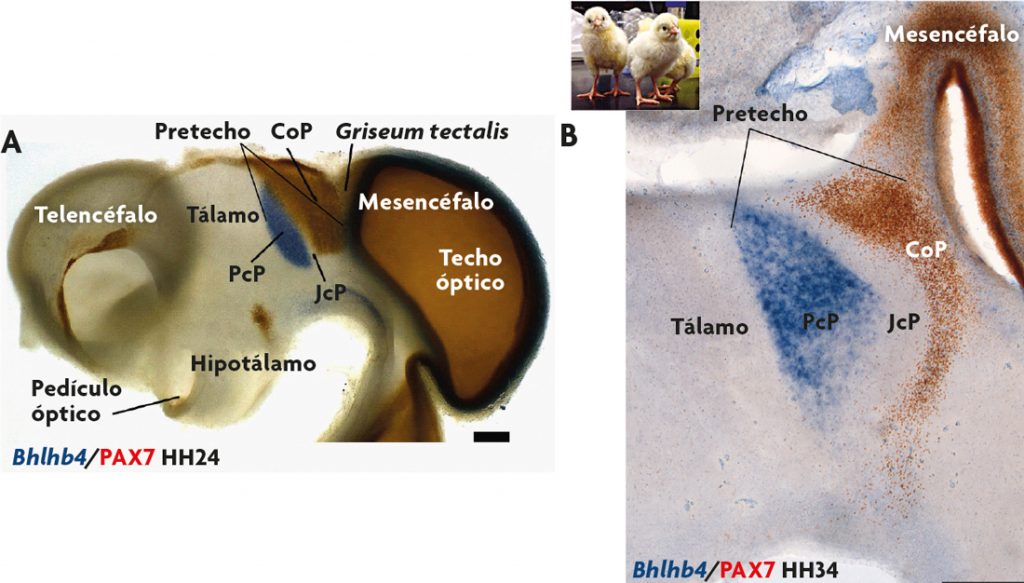
Figura 3. Genoarquitectura cerebral de aves. A) Vista lateral del cerebro de un pollo de cuatro días de desarrollo (estadio embrionario HH24). En el ejemplo se señala la región analizada (pretectum o pretecho), y se observan dos patrones de expresión que permiten definir distintas subdivisiones o dominios de expresión (ARNm del gen Bhlhb4, detectado mediante hibridación in situ; y proteína PAX7, detectada mediante inmunohistoquímica). B) Sección parasagital de un embrión de pollo de ocho días de desarrollo (HH34). Al analizar los mismos patrones de expresión génica (mensajero y proteína) se observa que ambos genes se expresan en las mismas subdivisiones del cerebro que en estadios previos. Mediante la exploración genoarquitectónica resultan evidentes tres dominios anteroposteriores de la región pretectal en todos los estadios analizados: precomisural (PcP), yuxtacomisural (JcP) y comisural (CoP). / José Luis Ferran
Ahora bien, los genes se expresan durante distintas etapas del desarrollo y de la vida postnatal de un individuo, y además lo hacen en regiones anatómicas diferentes. Por lo tanto, únicamente la presencia del producto de un gen no es suficiente para definir si el territorio identificado es comparable o no entre dos estadios de desarrollo de la misma especie (o entre dos especies diferentes). Se debe además conocer la posición que ocupan estos productos génicos dentro del plan general de organización del sistema nervioso central (su posición topológica). La genoarquitectura es una potente herramienta que permite caracterizar las regiones del sistema nervioso, así como las células y estructuras que derivan de ellas en estadios más tardíos y en la vida postnatal. A modo de ejemplo, en la figura 3 se muestra una imagen del sistema nervioso central de un embrión de pollo, en la que se puede reconocer una región del cerebro conocida como pretectum o pretecho que se localiza en la parte caudal del diencéfalo. Como se puede observar en estados tempranos del desarrollo, cuando esta región tiene todavía pocas células, se pueden identificar varias subdivisiones por los patrones de expresión de diferentes genes (su genoarquitectura). Si avanzamos en el desarrollo, las células que han derivado de estas regiones parecen conservar la expresión de estos genes (figuras 3 y 4). Es decir, esta herramienta permite distinguir células con identidades comunes, lo que nos proporciona una caracterización anatómica del cerebro mucho más elaborada que la que poseíamos (figura 4). Mediante la genoarquitectura se puede observar con sumo detalle cómo son las características anatómicas de esta zona durante todo el desarrollo embrionario y la vida postnatal de una especie (i.e. durante su ontogenia) (Ferran, Sánchez-Arrones, Sandoval y Puelles, 2007; Ferran et al., 2009).
«Al inicio del desarrollo los parecidos entre cerebros son significativos, ya que partimos de un plan común, pero cuando el desarrollo avanza hay variaciones en los tamaños de las regiones o en las características de sus células»
Por otra parte, el estudio comparado de la expresión de estos genes durante el desarrollo permite identificar regiones equivalentes en el cerebro de distintas especies de vertebrados (esto se conoce como homología de campo y las regiones comparadas se consideran homólogas; Puelles y Medina, 2002). Pero es importante insistir que solo son comparables las regiones de diferentes especies que tienen la misma localización dentro del plan general (misma posición topológica), o los grupos de células que se han originado a partir del mismo sitio. En nuestro caso, en la región pretectal que se muestra en la figura 5, se observa el mismo gen activo en la misma subdivisión de esta región tanto en pollo como en ratón. Esto nos revela que aves y mamíferos están usando los mismos genes en la construcción de esa región y permite reconocer la misma zona en dos especies distintas y muy lejanas evolutivamente entre sí (Ferran et al., 2008; Merchán, Bardet, Puelles y Ferran, 2011; Morona, Ferran, Puelles y González, 2011).
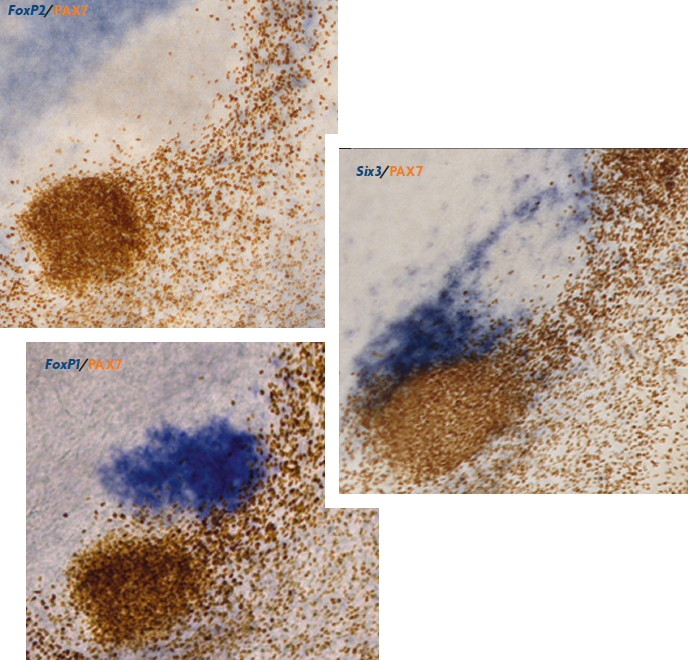
Figura 4. Detalle de la genoarquitectura del cerebro de pollo. Se muestra la expresión de cuatro productos codificados por diferentes genes en secciones a través del pretecho (la proteína PAX7, en marrón, y el ARNm de los genes FoxP2, FoxP1 y Six3, en azul). La expresión combinada de varios genes diferentes permite distinguir diferentes componentes celulares. / José Luis Ferran
La tarea más difícil es reconocer homologías cuando comparamos adultos o estadios avanzados del desarrollo, ya que las mismas regiones pueden llegar a ser muy diferentes en animales adultos de distintas especies, con genes activos también distintos. La dificultad es aún mayor si consideramos que a veces las células migran largas distancias a través de diferentes dominios, siendo muy difícil saber su sitio de origen si sólo se estudia la estructura en edad madura. En este caso, el estudio debe apoyarse en otras herramientas que nos indiquen de dónde ha derivado la estructura anatómica o las células de interés. La razón es que para considerar dos derivados como homólogos deben haberse originado a partir del mismo compartimento. Actualmente la genoaquitectura está siendo empleada para estudiar todas las regiones del cerebro en distintas especies, lo que proporciona detalles sobre el origen durante el desarrollo y la evolución de los distintos grupos de neuronas del cerebro inimaginables décadas atrás.
¿Podemos esperar más niveles de complejidad anatómica?
Hemos analizado como el producto de un gen, es decir el ARN mensajero, es una herramienta sumamente útil en la caracterización anatómica de regiones del cerebro y sus derivados. Para tal fin es suficiente con el uso de técnicas que identifican estos productos. Sin embargo, hoy en día sabemos que los ARN mensajeros producidos por un único gen pueden ser ensamblados de forma diferente, un proceso conocido como splicing alternativo.
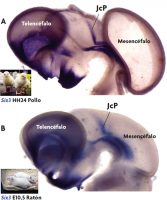
Figura 5. Genoarquitectura comparada entre vertebrados. A) Vista lateral del cerebro entero de un embrión de pollo (4 días de desarrollo) en la que se observa la expresión del gen Six3 en distintas regiones. Se indica una expresión bien definida en un dominio de la región pretectal (el dominio o subdivisión yuxtacomisural; JcP). B) Vista lateral del cerebro entero de un embrión de ratón (10,5 días de desarrollo) en donde se puede observar que el gen Six3 se expresa en el mismo dominio a nivel del pretecho. Teniendo en cuenta que ocupan la misma posición dentro del plan general de organización o construcción cerebral (Bauplan), podemos decir que ambos dominios de expresión son homólogos. / José Luis Ferran
Según este mecanismo, un gen puede dar lugar a productos de ARNm con diferencias en cuanto a su secuencia final; esto significa que un mismo gen puede producir distintas proteínas. En relación a nuestro estudio, implicaría que dos regiones anatómicas que están expresando el mismo gen podrían estar produciendo moléculas que no serían exactamente iguales y que podrían tener funciones diferentes. La caracterización en algunos casos de ARNm de splicing alternativo ha demostrado niveles adicionales en la complejidad de las estructuras anatómicas.
Genes arquitectos del cerebro humano
Los productos génicos tienen un rol fundamental en el desarrollo y funcionamiento del cerebro, pero además pueden ayudarnos a reconocer cual es el nivel de detalle en el que el cerebro de un humano se parece al de otro vertebrado. Al inicio del desarrollo los parecidos entre cerebros son significativos ya que partimos de un plan común, pero cuando el desarrollo avanza hay variaciones en los tamaños de las regiones o en las características de sus células, y en muchos casos aparecen «novedades» evolutivas. Conocer los detalles sobre la formación del cerebro de otros vertebrados nos permitirá avanzar en la comprensión de cómo se forma el cerebro humano durante el desarrollo y cuál es su origen evolutivo, así como en entender los posibles cambios que podría afrontar el cerebro de nuestra especie en este planeta o en otros que pudiéramos colonizar en un futuro cercano.
REFERENCIAS
Davidson, E. H. (2006). The regulatory genome. Burlington, MA: Academic Press.
Ferran, J. L., Sánchez-Arrones, L., Sandoval, J. E., & Puelles, L. (2007). A model of early molecular regionalization in the chicken embryonic pretectum. Journal of Comparative Neurology, 505(4), 379–403. doi: 10.1002/cne.21493
Ferran, J. L., Sánchez-Arrones, L., Bardet, S. M., Sandoval, J. E., Martínez-de-la-Torre, M., & Puelles, L. (2008). Early pretectal gene expression pattern shows a conserved anteroposterior tripartition in mouse and chicken. Brain Research Bulletin, 75(2–4), 295–298.
Ferran, J. L., de Oliveira, E. D., Merchan, P., Sandoval, J. E., Sánchez-Arrones, L., Martínez-de-la-Torre, M., & Puelles, L., (2009). Genoarchitectonic profile of developing nuclear groups in the chicken pretectum. Journal of Comparative Neurology, 517(4), 405–451. doi: 10.1002/cne.22115
Ferran, J. L., Ayad, A., Merchán, P., Morales-Delgado, N., Sánchez-Arrones, L., Alonso, A., … Puelles, J. (2015). Exploring brain genoarchitecture by single and double chromogenic in situ hybridization (ISH) and immunohistochemistry (IHC) in whole-mount embryos. En G. Hauptmann (Ed.), In situ hybridization methods (pp. 61–82). Nueva York: Springer. doi: 10.1007/978-1-4939-2303-8_4
Merchán, P., Bardet, S. M., Puelles, L., & Ferran, J. L. (2011). Comparison of pretectal genoarchitectonic pattern between quail and chicken embryos. Frontiers in Neuroanatomy, 5, 23. doi: 10.3389/fnana.2011.00023
Morona, R., Ferran, J. L., Puelles, L., & González, A. (2011). Embryonic genoarchitecture of the pretectum in Xenopus laevis: A conserved pattern in tetrapods. The Journal of Comparative Neurology, 519(6), 1024–1050. doi: 10.1002/cne.22548
Nieuwenhuys, R., Voogd, J., & Van Huijzen, C. (Eds.). (2008). The human central nervous system. Berlín: Springer. doi: 10.1007/978-3-540-34686-9
Ohno, S. (1970). Evolution by gene duplication. Londres: Allen and Unwin.
Puelles, L., & Ferran, J. L. (2012). Concept of neural genoarchitecture and its genomic fundament. Frontiers in Neuroanatomy, 6, 47. doi: 10.3389/fnana.2012.00047
Puelles, L., & Medina, L. (2002). Field homology as way to reconcile genetic and developmental variability with adult homology. Brain Research Bulletin, 57(3–4), 243–255.
Puelles, L., & Rubenstein, J. L. (2003). Forebrain gene expression domains and the evolving prosomeric model. Trends in Neuroscience, 26(9), 469–476. doi: 10.1016/S0166-2236(03)00234-0
Puelles, L. & Rubenstein J. L., (2015). A new scenario of hypothalamic organization: Rationale of new hypotheses introduced in the updated prosomeric model. Frontiers in Neuroanatomy, 9, 27. doi: 10.3389/fnana.2012.00047
Putnam, N. H., Butts, T., Ferrier, D. E. K., Furlong, R. F., Hellsten, U., Kawashima, T., … Rokshar, D. S. (2008). The amphioxus genome and the evolution of the chordate karyotype. Nature, 453(7198), 1064–1071. doi: 10.1038/nature06967