
Una de las cuestiones fundamentales del pensamiento biológico de todos los tiempos ha sido el esclarecimiento de la compleja relación entre estructura y vida, y en un sentido más práctico, entre salud y enfermedad. Bajo esta perspectiva, debemos señalar que el uso de remedios terapéuticos es tan antiguo como el mismo hombre y que mucho antes de que existiese cualquier tipo de ciencia, el hombre intentó resolver sus dolencias según su particular comprensión de la enfermedad y de los procesos vitales del organismo. En la actualidad asistimos a un desarrollo vertiginoso de la ingeniería genética que, gracias al descubrimiento del código genético, del genoma humano y de las técnicas enzimáticas capaces de modificarlo, han ampliado el espectro de las investigaciones básicas, ofreciendo la posibilidad de reprogramar los códigos celulares de los microorganismos y de las células eucariotas de los animales superiores. Así pues, estamos asistiendo a una revolución tecnológica que posiblemente marcará el destino del hombre en los próximos decenios y cuyo potencial beneficio en el área sociosanitaria, apenas acertamos a comprender.
«Enfermedades como el Parkinson podrían beneficiarse directamente de los avances en el conocimiento del genoma»
Genoma humano: salud y enfermedad
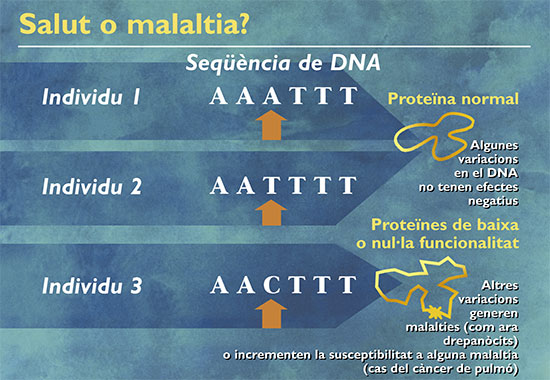
El genoma humano está constituido por la totalidad de la información genética almacenada en el DNA de las células. Dicha información contiene las instrucciones que determinan las características físicas y en parte psicológicas e intelectuales del individuo y, como extensión, dicha información le define e identifica como ser único e independiente. El genoma humano está constituido por un genoma nuclear y otro mitocondrial, cuyas denominaciones derivan de los respectivos lugares en donde el DNA se localiza en el interior de la célula. El genoma nuclear es el más importante por el volumen de información que almacena y es al que normalmente nos referimos con el término genoma humano. Está constituido en un 50% por la información genética derivada del padre y el otro 50% derivado de la madre. Dicha información permanece almacenada en las células somáticas siempre de forma físicamente independiente (constituyen los cromosomas homólogos) mientras que en las células germinales se produce una recombinación entre cromosomas homólogos, generando cromosomas singulares basados en la recombinación del DNA materno y paterno. En este sentido, el mecanismo de reproducción sexual (en contraste con la clonación) garantiza la estabilidad genética y la diversidad evolutiva de la especie.
Por último, debemos señalar que la herencia del genoma mitocondrial es exclusivamente materna, lo cual puede ser utilizado para seguir dicho linaje en el proceso de la herencia. Una vez conocida la secuencia de letras contenidas en el DNA que simbólicamente constituyen las palabras y frases de este gran libro de la vida, queda todavía un importante camino que recorrer antes de que dicha información pueda ser plenamente utilizada con fines sociosanitarios, ya que el conocimiento del genoma implica no sólo conocer el orden de las letras en que la información está dispuesta, sino que es necesario saber interpretar y comprender dicha información, saber la localización y relevancia de cada uno de los genes, así como sus implicaciones en el diagnóstico de las enfermedades y en la terapéutica personalizada de cada individuo. Pero no debemos olvidar que el genoma contiene la información para el desarrollo físico potencial del individuo y que su manifestación definitiva está condicionada por factores ambientales que modulan la expresión del genoma de cada persona.
«En la actualitat se sabe que más de 6.000 enfermedades tienen un origen claramente hereditario»
Los procedimientos utilizados hasta la actualidad para estudiar la expresión de los genes han sido muy selectivos y tediosos. Sin embargo, los procedimientos recientemente desarrollados (biochips) basados en análisis sobre micromatrices (microarrays) de DNA, permiten analizar miles de genes de forma simultánea, utilizando un soporte (chip) con una superficie de unos pocos centímetros cuadrados. Esta nueva capacidad de análisis masivo del genoma ofrece la oportunidad de estudiar la interrelación entre genes o grupos de genes, su implicación en la actividad funcional normal de la célula o su patología, así como suministrar valiosa información acerca de la influencia de sustancias químicas exógenas sobre la alteración y/o expresión de los genes en los individuos. En la actualidad se sabe que más de seis mil enfermedades tienen un origen claramente hereditario, aunque sólo en un 3% de los casos se ha podido llegar a identificar el gen responsable de la misma. Enfermedades como el parkinson, alzheimer, hemofilia, síndrome de Down, multitud de patologías cardíacas, etc. podrían beneficiarse directamente de los avances en el conocimiento del genoma, pero también otras enfermedades adquiridas como son el cáncer, las enfermedades infecciosas, etc., podrán ser abordadas con renovadas esperanzas desde el punto de vista sociosanitario. En este sentido, los biochips ofrecen un beneficio potencial considerable en el ámbito del diagnóstico y tratamiento de la práctica totalidad de las enfermedades. Tanto es así, que comienza a perfilarse una nueva disciplina, la farmacogenómica, la rama del conocimiento cuyo objeto es estudiar y establecer las correlaciones entre la respuesta terapéutica a los fármacos y el perfil genético del paciente. Por último, cabe señalar que la utilización directa de los ácidos nucleicos con fines terapéuticos es objeto de una nueva rama de la terapéutica, acuñada con el nombre de terapia génica. Aunque los importantes avances en este campo no se han visto coronados por éxitos clínicos equivalentes, los investigadores tienen puestas en esta nueva estrategia terapéutica grandes esperanzas y confían en la consolidación de la futura medicina molecular. Es razonable pensar que un conocimiento completo desde el punto de vista estructural y funcional del genoma humano no se alcanzará antes de varias décadas, pero debemos señalar que el conocimiento adquirido en los últimos años sobre el genoma nos ha de permitir comprender mejor la normalidad y la enfermedad, las limitaciones y expectativa de vida de un individuo, las bases moleculares de la enfermedad, los mecanismos de la diferenciación celular, la regulación de la expresión de los genes, la biodiversidad de los individuos y las especies en la naturaleza, además de cómo en la actualidad los avances en la tecnología del DNA recombinante o ingeniería genética, sumados a los conocimientos derivados del Proyecto Genoma Humano, tendrán una repercusión directa en las nuevas terapias basadas en la utilización de elementos genéticos (terapia génica); también nos ofrecerá un marco de comprensión del significado potencial de la clonación humana y su posible aplicación en el transplante, como fuente inagotable de tejidos y órganos.
«La terapia génica se presenta como una promesa terapéutica de utilidad en todo tipo de patologías»
Farmacogenómica, una de las ramas con más futuro de la industria farmacéutica.
La farmacogenómica emerge como una de las ramas más prometedoras de la industria farmacéutica, entre las originadas en la era postgenómica. Es una de las ramas del saber que está ganando, de forma progresiva, un reconocimiento y respeto en la comunidad científica, debido en gran medida a su capacidad para ofrecer, al menos, tres de los principales productos derivados del genoma, tales como información, productos para el diagnóstico y productos con fines terapéuticos. El objeto de la farmacogenómica es el estudio del impacto de la variación genética sobre la eficacia y toxicidad de los fármacos o, expresado en otros términos, el estudio de la importancia de determinados marcadores genéticos del paciente en relación con la predicción de la respuesta a un determinado fármaco. La idea de la existencia de respuestas alteradas en razón de diferencias genéticas no es nueva y, así, la observación en el siglo VI aC de que el consumo de habas podía generar en ciertas personas anemia hemolítica, fue posteriormente relacionado (siglo XX) con un déficit de una enzima (glucosa-6-fosfatasa) en estos pacientes. Pronto se descubrieron nuevas diferencias que inicialmente fueron atribuidas a variaciones genéticas y la causa de su patología no pudo ser adecuadamente explicada hasta el advenimiento de la biología molecular. Los polimorfismos proteicos, identificados como resultado de variaciones en la secuencia de nucleótidos del DNA, permiten identificar muchas patologías, algunas de las cuales son el resultado de mutaciones puntuales de un solo nucleótido (polimorfismo de nucleótido simple). Pero los polimorfismos genéticos no son sólo importantes para determinar la predisposición a sufrir una determinada patología, sino que también permiten determinar: I) la disponibilidad en el paciente de proteínas transportadoras del fármaco (ej. ATPasa Na+/K+, proteína de resistencia a múltiples drogas, etc); II) la capacidad de la persona en cuestión para eliminar el fármaco, en función de la disponibilidad de los enzimas responsables de su metabolización (ej. enzimas del sistema citocromo P-450); III) la densidad y/o funcionalidad de los receptores sobre los que deben actuar los fármacos (ej. enzima convertidor de angiotensina, receptores‚ adrenérgicos). En este sentido, la farmacogenómica está destinada a ocupar un importante lugar en el cuidado de la salud, ya que la medicina, los pacientes y también la industria farmacéutica se beneficiarán de las ventajas de una terapéutica personalizada en el paciente. En un futuro próximo, el perfil genético de un determinado paciente estará disponible para el clínico, probablemente mediante dispositivos electrónicos, de forma que las estrategias terapéuticas se optimizarán desde el inicio del tratamiento.
Genoterapia
La terapia génica es una nueva estrategia terapéutica basada en la modificación genética de las células, utilizando los ácidos nucleicos como medicamentos o dianas terapéuticas. Este procedimiento ofrece un gran potencial terapéutico, ya que permite abordar el tratamiento tanto de enfermedades de origen hereditario (enfermedades genéticas monogénicas como hemofilia, fibrosis quística, etc.) como adquiridas (cáncer, enfermedades infecciosas, vacunas, etc).
Las estrategias en terapia génica están basadas bien en aumentar la dotación genética de células somáticas, mediante la introducción de nuevas copias de un gen (con el fin de amplificar el producto final del mismo en una célula normal o de restablecer su fenotipo normal en enfermedades genéticas hereditarias) o, por el contrario, en tratar de inhibir la expresión génica en aquellas células en las que la presencia de un nuevo producto génico o la inadecuada expresión del mismo son los responsables de una determinada patología, como es el caso de las enfermedades infecciosas y el cáncer. Otras estrategias están dirigidas a provocar la muerte celular o corregir mutaciones. En el primer caso, es posible introducir en las células diana genes que codifican un producto tóxico letal o genes cuyo producto facilita la transformación de un profármaco en un metabolito tóxico para la célula. Pero también es posible provocar la muerte celular de modo indirecto, mediante la introducción de genes activadores de la respuesta inmunitaria que promuevan una respuesta citotóxica eficaz. En cuanto a la corrección de mutaciones, es una estrategia compleja que puede ser orientada tanto a corregir defectos génicos, mediante procedimientos de recombinación homóloga, o bien en el RNA, utilizando por ejemplo tipos particulares de ribozimas (RNA con actividad catalítica) terapéuticos.
Hay que señalar que el conocimiento adquirido en los últimos años sobre el genoma nos debe permitir comprender mejor la normalidad y la enfermedad, las limitaciones y expectativa de vida de un individuo, las bases moleculares de la enfermedad, los mecanismos de la diferenciación celular, la regulación de la expresión de los genes y la biodiversidad de los individuos y de las especies en la naturaleza. / Imagen: U.S. Departament of Energy Human Genome. http://www.ornl.gov/hgmis
Dado que los ácidos nucleicos presentan escasa biodisponibilidad tras su administración sistémica, se requiere la utilización de vectores de transferencia para mejorar su eficacia. Existen dos clases principales de vectores: los sistemas virales y los no virales. Los vectores virales (retrovirus, lentivirus, adenovirus, virus adenoasociados, etc.) aprovechan el tropismo y la capacidad de los virus para infectar células y expresar con gran eficacia su información genética, incluyendo aquellos genes que con fines terapéuticos pudieran serle incorporados, mediante las técnicas del DNA recombinante. Por el contrario, los vectores no virales (liposomas, complejos de DNA con lípidos, péptidos, polímeros, etc.) son menos eficaces pero ofrecen como ventaja la seguridad, ya que evitan los problemas relacionados con la inmunogenicidad viral y la posible reversión del fenotipo infeccioso. Asimismo, los sistemas no virales ofrecen otras ventajas potenciales, como son la mejor manufactura, caracterización y formulación de los genes como medicamentos. Sin embargo, se requieren todavía importantes esfuerzos para conseguir que este tipo de vectores pueda reunir las características de eficacia (y seguridad) suficientes que justifiquen mejor su utilización en clínica.
A pesar de los escasos éxitos clínicos alcanzados, la terapia génica se presenta como una promesa terapéutica de utilidad en todo tipo de patologías y en la actualidad no cabe duda de que la adecuada articulación de estos conocimientos, junto con los avances propiciados por el Proyecto Genoma Humano, así como el mejor conocimiento de las bases moleculares de la patología, los estudios experimentales en terapia génica y el desarrollo de vectores que permitan la entrega selectiva de genes con seguridad y eficacia, harán posible en un futuro próximo que la utilización de genes y/o ácidos nucleicos como fármacos o medicamentos sea una realidad con insospechadas aplicaciones terapéuticas.
Cavazzana-Calvo, M., Hacein-Bey, S., Yates F. De Villartay, J. P., Le Deist, F. y A. Fischer, 2001. «Gene therapy of severe combined immunodeficiencies». Journal of Gene Medicine. 3: 201-206
Dasí, F., Lledó, S., García-Granero, E., Ripoll, R., Marugán, M., Tormo M., García-Conde, J. y S. F. Aliño, 2001. «Real-time quantification in plasma of human telomerase reverse transcriptase (hTERT) mRNA: a simple blood test to monitor disease in càncer patients». Laboratory Investigation. 81: 767-769
Nishikawa, M. y L. Huang, 2001. «Nonviral Vectors in the New Millennium: Delivery Barriers in Gene Transfer». Human Gene Therapy. 12: 861-870
Peet, N. P. y P. Bei, 2001. «Pharmacogenomics: challenges and opportunities». Drug Discovery Today. 6: 495-498
Schimtz, G., Aslanidis, C. y K. J. Lackner, 2001. «Pharmacogenomics: implications for laboratory medicine». Clínica Chimica Acta: 308: 43-53
Xiang, C. C. y Y. Chen, 2000. «cDNA microarray technology and its applications». Biotechnology Advances. 18: 35-36





