Medicamentos contra las drogas
Desarrollo de fármacos para prevenir y tratar los trastornos por uso de sustancias

Los trastornos por uso de sustancias o TUS representan un problema considerable de salud pública. Por desgracia, existen pocos medicamentos seguros y efectivos para tratarlos, y la eficacia de los que existen es mejorable. Hay importantes obstáculos financieros y científicos para el desarrollo de nuevos compuestos, pero el reciente descubrimiento de nuevos receptores y circuitos neuronales ofrece nuevas oportunidades para desarrollar farmacoterapias novedosas. Es necesario un enfoque científico sistemático para demostrar su seguridad y eficacia, comercializarlas y prescribirlas a los pacientes. El propósito de este artículo es proporcionar una visión general de los desafíos y oportunidades en el desarrollo de medicamentos para los trastornos por uso de sustancias y describir el enfoque por etapas de este desarrollo, los medicamentos aprobados y aquellos que parecen más prometedores.
Palabras clave: desarrollo de medicamentos, trastornos por uso de sustancias, tratamiento, ensayos clínicos.
Introducción
El desarrollo de medicamentos para prevenir y tratar los trastornos por el consumo de sustancias ilegales es un asunto de salud pública prioritario que requiere la colaboración científica y financiera de investigadores académicos, agencias públicas y la industria farmacéutica. Según la Encuesta Nacional de Consumo de Drogas y Salud de los Estados Unidos (NSDUH, por sus siglas en inglés) de 2019, aproximadamente 8,3 millones de individuos sufren trastornos por uso de sustancias (TUS), pero solo un millón y medio recibían tratamiento con medicamentos aprobados por la Administración de Medicamentos y Alimentos (FDA en sus siglas en inglés) (SAMHSA, 2019). Por lo tanto, la mayoría de pacientes con este tipo de trastornos no están siendo tratados. Esto se debe, en parte, a la falta de acceso a tratamiento farmacológico, pero principalmente a la escasez de medicamentos aprobados para su trastorno y su limitada eficacia. Esta brecha en el tratamiento debe abordarse urgentemente con más farmacoterapias seguras, efectivas y disponibles para los pacientes con trastornos por uso de sustancias (Rasmussen et al., 2019).
Pese a lo crítico de esta necesidad, existen solo un puñado de compañías farmacéuticas o biotecnológicas interesadas en el desarrollo de medicamentos para los trastornos por uso de sustancias. Esto se debe en parte a la idea errónea de que es poco rentable y a los desafíos planteados por la población de pacientes objetivo, debido a sus múltiples comorbilidades médicas y psiquiátricas, la impredecible motivación para seguir el tratamiento y los malos resultados. Sin embargo, el mercado actual de medicamentos aprobados para los trastornos por consumo de opioides es de más de 1.200 millones de dólares al año y se han propuesto múltiples estrategias para incentivar a la industria farmacéutica a abordar el área de los trastornos por uso de sustancias, como la introducción de bonos y el aumento de la duración de las patentes, pero ninguna de estas opciones se ha puesto en marcha y cada vez más compañías abandonan el desarrollo de medicamentos psicoterapéuticos para los trastornos neuronales, incluyendo los producidos por uso de sustancias (Skolnick y Volkow, 2012).
Retos y oportunidades
El desarrollo de medicamentos para los trastornos por uso de sustancias requiere un considerable apoyo financiero y científico. El tiempo medio desde que se descubre un nuevo compuesto hasta que se obtiene la aprobación de agencias reguladoras como la FDA es de catorce años, si todo va bien. El coste aproximado de desarrollo de un medicamento exitoso desde su descubrimiento hasta su aprobación es de cerca de 2.400 millones de dólares. Por otro lado, invertir en el desarrollo de medicamentos seguros y efectivos para tratar estos trastornos puede ahorrar millones de dólares en pérdida de productividad y, lo que es más importante, salvar muchas vidas. Por lo tanto, el aumento de opciones de tratamiento para los trastornos por uso de sustancias es claramente rentable y productivo.
Desde el punto de vista científico, estos trastornos son condiciones clínicas caracterizadas por el consumo compulsivo de una droga pese a sus consecuencias físicas, psicológicas y sociales. El inicio y la progresión del consumo de drogas está asociado con factores de riesgo biológicos, sociales y psicológicos. El consumo crónico de drogas se ha asociado con cambios neuronales que podrían explicar los cambios en las prioridades vitales de los pacientes, así como otras manifestaciones clínicas como el síndrome de abstinencia y el deseo de consumir (craving), que perpetúan la situación.
«Muy pocas compañías están interesadas en el desarrollo de medicamentos para los trastornos por el consumo de sustancias»
Los avances científicos en la comprensión de los efectos del consumo agudo y crónico de drogas en el cerebro, sus circuitos y neurotransmisores están ofreciendo oportunidades sin precedentes para descubrir nuevos objetivos farmacológicos y desarrollar nuevos medicamentos para tratar los trastornos por uso de sustancias. Además, los avances en la comprensión de la base genética y epigenética de estos trastornos han proporcionado nuevas oportunidades para aprender sobre farmacogenética y sobre efectos concretos de las drogas de abuso, y también sobre la seguridad y eficacia de medicamentos que permiten tomar enfoques farmacológicos más individualizados.
Los avances en inmunología también están permitiendo el desarrollo de productos biológicos como vacunas, anticuerpos monoclonales y enzimas que pueden alterar el perfil farmacocinético de los medicamentos, y utilizarse para tratar los trastornos por uso de sustancias y para evitar las sobredosis. Las vacunas antidroga producen una respuesta inmunológica caracterizada por la producción de anticuerpos contra una droga concreta. Los anticuerpos monoclonales de laboratorio se unen a la droga y crean un gran par antígeno-anticuerpo que no puede traspasar la barrera hematoencefálica, por lo que evitan que la droga llegue al cerebro. El objetivo final de las vacunas y los anticuerpos monoclonales es producir un antagonismo farmacocinético y proteger al sistema nervioso central de los efectos de la droga y sus consecuencias neurocomportamentales. Las enzimas de diseño desarrolladas para tratar estos trastornos tienen la propiedad de acelerar de manera significativa el catabolismo de la droga, mucho más rápido que las enzimas naturales. Así, cuando la droga entra en el torrente sanguíneo, la enzima de diseño descompone la droga antes de que llegue al cerebro. De esta forma evita sus efectos neurocomportamentales, incluyendo el circuito de recompensa responsable del consumo compulsivo (Montoya, 2016).
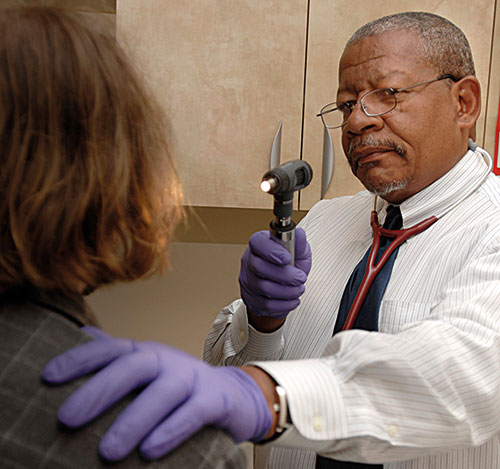
La investigación clínica para conseguir nuevos medicamentos para tratar los trastornos por el consumo de sustancias conlleva el riesgo de que el medicamento estudiado tenga propiedades adictivas, lo cual podría agregar otra adicción al paciente. Normalmente, la investigación clínica de fase I cuenta con la colaboración de voluntarios que no buscan tratamiento. En la imagen, un médico del Instituto Nacional sobre el Abuso de Drogas de los EE UU examina a un paciente participante en un programa de investigación. / NIDA (NIH)
Etapas del desarrollo de medicamentos
Para que las agencias reguladoras aprueben un nuevo medicamento y este llegue a los pacientes, los compuestos nuevos deben pasar un riguroso e imparcial proceso de evaluación científica, que incluye una extensa investigación preclínica y clínica. Para los trastornos por uso de sustancias, este proceso tiene algunos aspectos distintivos, puesto que el consumo compulsivo de una sustancia ilegal podría producir interacciones farmacológicas con el medicamento estudiado. Además, también existe el riesgo de que el medicamento estudiado tenga propiedades adictivas y aumente el riesgo de añadir una nueva adicción en el paciente.
Fase preclínica
En la fase preclínica de la investigación, se prueba el compuesto en animales para determinar su seguridad potencial para los humanos y su eficacia preliminar en los modelos animales pertinentes. Los estudios en animales son críticos en este proceso de desarrollo. Para los trastornos por uso de sustancias, es necesario evaluar la propensión al abuso de los nuevos compuestos y determinar el riesgo de desarrollar una adicción. Es poco probable que un compuesto que genere propensión al abuso en animales llegue a aprobarse para continuar la investigación con pruebas en humanos. Los protocolos de discriminación de drogas, condicionamiento de la preferencia de lugar y la autoadministración ayudan a determinar si los animales pueden reconocer o preferir el medicamento por encima de la comida u otros refuerzos. Los estudios en animales también son importantes para determinar los efectos toxicológicos potenciales y las interacciones adversas con otras drogas o medicamentos. Uno de los problemas de los modelos animales es que estos trastornos son muy heterogéneos y es difícil predecir los efectos en humanos a partir de estos modelos. Sin embargo, son muy utilizados, y tendrá que seguir siendo así hasta que puedan validarse gracias a medicamentos que hayan demostrado su eficacia (Banks et al., 2019).
Fase clínica
La fase de investigación clínica se divide en cuatro etapas, descritas por la FDA como fases I-IV. Los estudios de fase I también se llaman «primero en humanos», porque el objetivo es determinar la seguridad médica de administrar el nuevo compuesto a humanos. Suelen incluir a un número relativamente pequeño de participantes que pueden o no tener antecedentes de consumo de drogas y a los que se compensa económicamente por exponerse a los potenciales riesgos del nuevo medicamento. Este tipo de estudio suele ir seguido de un segundo estudio de fase I, normalmente llamado «fase Ib», que determina las interacciones farmacológicas entre el nuevo medicamento y las drogas. Este tipo de estudio es particularmente relevante cuando se sospecha que el medicamento investigado podría aumentar el riesgo o los efectos de las drogas. Un componente importante de los estudios de fase I es la evaluación de la propensión al abuso del nuevo medicamento. Estos estudios se llevan a cabo con voluntarios humanos con experiencia con los efectos de otras drogas de la misma categoría farmacológica. Por razones éticas, se realizan con individuos que no están interesados en recibir tratamiento, puesto que se les expone a drogas que podrían tener potencial adictivo. Las medidas estándar incluyen calificaciones subjetivas de los efectos de los compuestos, incluyendo efectos placenteros, euforia, somnolencia y otros efectos cognitivos o conductuales (Epstein et al., 2006).
Los ensayos clínicos de fase II se suelen conocer como estudios de «prueba de concepto», puesto que su objetivo es determinar la eficacia preliminar del medicamento en pacientes que buscan tratamiento. Estos estudios suelen llevarse a cabo con pacientes ambulatorios y con muestras de entre 50 y 100 participantes. Así pues, es fundamental seleccionar criterios de valoración o resultados que representen una mejora clínica significativa del trastorno evaluado. Los criterios de valoración dependerán del trastorno específico del paciente. Las pruebas toxicológicas en la orina y otros fluidos humanos permiten evaluar de una forma razonablemente objetiva la frecuencia e intensidad de consumo y la severidad del trastorno. Sin embargo, en términos clínicos, el resultado de un test de drogas no es un indicador absoluto del funcionamiento del individuo. Por lo tanto, se han desarrollado y validado otros criterios de valoración para lograr obtener una idea más completa de la situación clínica real del paciente. Algunos ejemplos son la impresión clínica global o el índice de severidad de la adicción (Kiluk et al., 2016; Kleykamp et al., 2019; Loflin et al., 2020; Montoya et al., 1995).
Los ensayos de fase III son el patrón de referencia para determinar la seguridad y eficacia de un compuesto. Se suelen llevar a cabo con grandes muestras de pacientes que se espera que reflejen la «realidad» de los pacientes de un trastorno concreto. El objetivo es confirmar la eficacia demostrada en los ensayos de fase II y servir de apoyo para las indicaciones de tratamiento específicas del medicamento. Por lo tanto, una selección correcta de los criterios de valoración y el enfoque estadístico de la fase previa son esenciales, porque los resultados de este estudio se presentan a las agencias reguladoras con el objetivo de obtener el permiso para comercializar el producto (Yu et al., 2008).
Los estudios de fase IV se suelen considerar parte del proceso de monitorización posterior a la comercialización, y suele llevarlos a cabo la compañía farmacéutica. El objetivo es identificar efectos secundarios poco comunes del fármaco que pasaron desapercibidos en las fases anteriores. Esta fase también incluye estudios con poblaciones que ya estaban presentes en fases anteriores del proyecto.
Medicamentos aprobados y en desarrollo
Actualmente existen varios medicamentos para los trastornos por uso de sustancias que han pasado por este riguroso proceso de evaluación y aprobación. La FDA aprobó la metadona en 1972 para tratar el trastorno por consumo de opioides, y hoy se usa ampliamente en la mayoría de países. La buprenorfina, por sí sola y en combinación con la naloxona, se aprobó en 2002 y ha ganado aceptación rápidamente entre los prescriptores médicos por su propiedad farmacológica única como agonista parcial de los opioides. Más recientemente, en 2016, se aprobó un implante de seis meses, y en 2017, una fórmula inyectable de buprenorfina de acción prolongada.
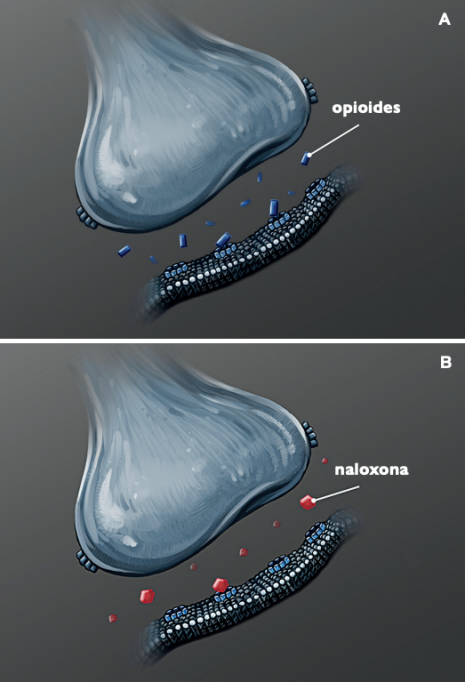
Los receptores de opioides (en azul claro en las imágenes A y B) se encuentran en las células nerviosas de todo el cuerpo y tienen varios efectos cuando son activadas por los opioides, como producir una sensación de confort y somnolencia. Como antagonista de los opioides, la naloxona se asienta en los receptores de opioides (imagen B), los bloquea y elimina a otros opioides. La naloxona se aprobó en 1971 para el tratamiento de las sobredosis por opioides, y en 2015 la FDA aprobó una formulación intranasal que ha salvado a muchas personas de morir por sobredosis. / NIDA (NIH)
Para evitar recaídas en el trastorno por uso de opioides, la naltrexona (un antagonista opioide) lleva aprobada desde 1984, aunque se receta muy poco. Para superar esta barrera, se aprobó una fórmula de naltrexona de acción prolongada (mensual) en 2010. La aceptación por parte de los médicos y los pacientes ha sido baja porque los pacientes deben desintoxicarse y no utilizar opioides al menos en las dos semanas anteriores a la primera inyección, para evitar provocar síndrome de abstinencia (Coffa y Snyder, 2019).
Según la NSDUH, en 2019 había 746.866 pacientes en tratamiento con buprenorfina, 637.157 con metadona y 77.872 con naltrexona en los Estados Unidos (SAMHSA, 2019). Otros medicamentos que forman parte del arsenal de tratamientos pero no están incluidos en los datos de la NSDUH son la naloxona y la lofexidina. La naloxona se aprobó en 1971 para tratar las sobredosis de opioides. Más recientemente, debido a la pandemia de abuso de opioides en los Estados Unidos, se desarrolló una formulación intranasal, aprobada por la FDA en 2015. Esta formulación ha salvado la vida de muchas personas que han sufrido una sobredosis por opioides. Sin embargo, la epidemia de sobredosis de los Estados Unidos continúa, y en 2018 se produjeron casi 50.000 muertes por sobredosis de opioides, cerca de 35.000 de las cuales debido al fentanilo u otros opioides sintéticos además de la metadona (Kreek et al., 2019). La lofexidina es un medicamento para la hipertensión aprobado por la FDA en 2018. Su objetivo es tratar los síntomas de la abstinencia de opioides en pacientes dependientes de estas sustancias que dejen de consumirlas. Puede ayudar a los pacientes que quieren desintoxicarse y que pueden pasar a evitar las recaídas con naltrexona (Yu et al., 2008).
Para responder a la necesidad pública de tener más medicamentos disponibles para tratar los trastornos por uso de sustancias, en 1989, el Congreso de los EE UU ordenó la creación del Programa de Desarrollo de Medicamentos por parte del Instituto Nacional sobre el Abuso de Drogas (NIDA en sus siglas en inglés). Su objetivo era responder con rapidez y eficiencia a la crisis de consumo de drogas mediante el apoyo y la financiación para el desarrollo de medicamentos para estos trastornos. Desde sus inicios, el programa ha evaluado cientos de medicamentos, y solo unos pocos han alcanzado la meta de ser aprobados por la FDA. El programa ha recibido alabanzas por apoyar el desarrollo de la naltrexona, el levacetilmetadol (también conocido como LAAM), la buprenorfina (por sí sola y en combinación con naloxona), los implantes de buprenorfina, y la lofexidina (Johnson y Vocci, 1993; Vocci y Ling, 2005).
Tras más de treinta años de investigación, no hay medicamentos aprobados por la FDA para tratar a los pacientes con trastornos relacionados con el consumo de cánnabis, cocaína o metanfetamina. Esto es especialmente desafortunado porque los trastornos por el consumo y las sobredosis relacionadas con estas drogas han aumentado dramáticamente en los últimos años. Los informes indican que, entre 2010 y 2018, las muertes por sobredosis de cocaína y metanfetamina se han cuadruplicado, hasta un total de 14.666 y 12.676, respectivamente. Actualmente hay cerca de cuatro millones y medio de individuos con trastornos por el consumo de cánnabis, un millón con trastornos relacionados con la metanfetamina y otro millón con trastorno por consumo de cocaína (SAMHSA, 2019). Por lo tanto, un medicamento aprobado para tratar cualquiera de estos trastornos supondría una ayuda considerable a la salud pública y una oportunidad de mercado única para aquellas compañías farmacéuticas que se comprometan con esta área.
Para los trastornos relacionados con el consumo de estimulantes (cocaína y metanfetamina), tras muchos años de investigación y grandes inversiones de tiempo y dinero, continuamos sin tener ninguna farmacoterapia aprobada por las agencias reguladoras. Se han probado muchos enfoques, objetivos, medicamentos y aproximaciones biológicas. La diana farmacológica más común ha sido el sistema dopaminérgico, pero los resultados han sido decepcionantes. También se ha apuntado a otros sistemas como el noradrenérgico, serotoninérgico, glutamatérgico, gabaérgico, etc., con el mismo resultado. Lo mismo ha ocurrido más recientemente con productos biológicos como las vacunas, los anticuerpos monoclonales y las enzimas de diseño. Por desgracia, en estos momentos no hay medicamentos en ensayos clínicos de fase iii para estos trastornos, y puede que aún falten años para que se apruebe un tratamiento farmacológico. Esta es un área en la que necesitamos urgentemente más colaboración entre la industria, los académicos y las agencias gubernamentales (Montoya, 2012; Montoya y McCann, 2010; Ronsley et al., 2020).
«Las vacunas antidroga producen una respuesta inmunológica caracterizada por la producción de anticuerpos contra una droga concreta»
En cuanto a los trastornos por consumo de cánnabis, existe un debate sobre la necesidad de tratamientos, debido a la percepción general de bajo riesgo de su consumo. Sin embargo, como indica el informe de 2019 de la NSDUH, casi cinco millones de personas en los EE UU cumplían los criterios para considerar el trastorno y 827.000 recibieron tratamiento. Además, se ha investigado lo suficiente como para confirmar que el consumo crónico de cánnabis tiene graves consecuencias físicas y psicológicas, entre ellas el síndrome de abstinencia. Por lo tanto, la necesidad de desarrollar medicamentos para tratar estos trastornos es evidente. Se han investigado diversos medicamentos, algunos de ellos dirigidos al trastorno en su totalidad y otros para algunos aspectos concretos, como los trastornos del sueño, el síndrome de abstinencia, la reducción de los efectos de refuerzo y la prevención de recaídas. Los medicamentos más investigados se dividen en dos grupos: aquellos que tienen un efecto sobre el sistema cannabinoide (como los agonistas cannabinoides, agonistas parciales, agonistas, etc.) y los que afectan a otros sistemas neurotransmisores (serotoninérgico, gabaérgico, noradrenérgico, etc.). Desafortunadamente, los intentos de encontrar medicamentos seguros y efectivos para el trastorno por consumo de cánnabis no han tenido éxito. No obstante, el Instituto Nacional sobre el Abuso de Drogas, en colaboración con investigadores académicos y de la industria farmacéutica, siguen buscando opciones de intervención seguras y efectivas para este desorden (Montoya y Weiss, 2018; SAMHSA, 2019; Vandrey y Haney, 2009).
Dada la actual epidemia de consumo de opioides en los EE UU, se han redoblado los esfuerzos para el desarrollo de medicamentos más seguros y efectivos para el trastorno por consumo de opioides. Este esfuerzo se ha canalizado a través de la iniciativa HEAL (“Ayudar a terminar con la adicción a largo plazo”) de los Institutos Nacionales de Salud. Actualmente, más de cuarenta nuevos compuestos y medicamentos están en proceso de evaluación en este programa, incluyendo pequeñas moléculas y productos biológicos para prevenir o tratar el trastorno por consumo de opioides y las sobredosis. El objetivo es ampliar las opciones clínicas para el tratamiento de estas afecciones (Collins et al., 2018).
Conclusiones
El desarrollo de medicamentos para prevenir o tratar los trastornos por uso de sustancias y las sobredosis es un proceso complicado y costoso que a menudo no consigue alcanzar la aprobación por parte de las agencias reguladoras. Un compuesto nuevo puede fracasar por problemas de seguridad médica o por falta de eficacia. Además de los riesgos médicos habituales, los compuestos para los trastornos por uso de sustancias también pueden fracasar por su potencial propensión al abuso, por inducir iatrogénicamente una nueva adicción o por interacciones adversas con alguna droga (por ejemplo, el aumento de la depresión respiratoria por los opioides o la toxicidad cardiovascular de los estimulantes).
«El desarrollo de medicamentos para prevenir o tratar los trastornos por el consumo de sustancias y las sobredosis es un proceso complicado y costoso»
Muchos esfuerzos de investigadores académicos, de la industria o de la Administración pública han conseguido la aprobación de farmacoterapias para el trastorno por consumo de opioides y la sobredosis. Sin embargo, aún podemos mejorar su seguridad y eficacia. Diversas iniciativas del gobierno estadounidense como HEAL o el Programa de Desarrollo de Medicamentos del Instituto Nacional sobre el Abuso de Drogas, con la colaboración de investigadores académicos y de la industria, están impulsando la investigación y el desarrollo de medicamentos. Se espera que en pocos años se aprueben más medicamentos, con lo que podremos ampliar el arsenal terapéutico y reducir la carga sanitaria de estos trastornos, mejorando al mismo tiempo la calidad de vida de las personas que los sufren.
Por último, la pandemia de COVID-19 ha tenido consecuencias devastadoras para estos trastornos, así como para el avance de la investigación de estos medicamentos (Volkow, 2020). El cierre temporal de laboratorios de investigación animal ha retrasado considerablemente las pruebas preclínicas de nuevos compuestos, y la situación ha sido todavía más complicada para la investigación clínica. Las juntas de gobierno de muchas instituciones han ordenado detener la búsqueda de nuevos participantes para sus ensayos clínicos, y los que ya estaban implicados antes de la pandemia solo pudieron permanecer en los estudios por cuestiones de atención clínica, con una mínima recopilación de datos. Además, algunas metodologías de estudio, pruebas de laboratorio y evaluaciones se tuvieron que adaptar a las prioridades relacionadas con la COVID-19, y la FDA priorizó todas las solicitudes relacionadas con el virus, mientras que la aprobación de medicamentos no relacionados sufrió considerables retrasos. Por lo tanto, el progreso del desarrollo de medicamentos para los trastornos por uso de sustancias anterior a la pandemia se ha visto ralentizado, y es probable que la disponibilidad de nuevos medicamentos se retrase. Cuando acabe la pandemia o aprendamos a convivir con el virus, se espera que el desarrollo de medicamentos acelere, se pueda recuperar parte del tiempo perdido y medicamentos seguros y eficaces para tratar estos trastornos estén disponibles en un futuro cercano.
Referencias
Banks, M. L., Townsend, E. A., & Negus, S. S. (2019). Testing the 10 most wanted: A preclinical algorithm to screen candidate opioid use disorder medications. Neuropsychopharmacology, 44(6), 1011–1012. https://doi.org/10.1038/s41386-019-0336-5
Coffa, D., & Snyder, H. (2019). Opioid use disorder: Medical treatment options. American Family Physician, 100(7), 416–425. PMID: 31573166
Collins, F. S., Koroshetz, W. J., & Volkow, N. D. (2018). Helping to end addiction over the long-term: The research plan for the NIH HEAL Initiative. JAMA, 320(2), 129–130. https://doi.org/10.1001/jama.2018.8826
Epstein, D. H., Preston, K. L., & Jasinski, D. R. (2006). Abuse liability, behavioral pharmacology, and physical-dependence potential of opioids in humans and laboratory animals: Lessons from tramadol. Biological Psychology, 73(1), 90–99. https://doi.org/10.1016/j.biopsycho.2006.01.010
Johnson, D. N., & Vocci, F. J. (1993). Medications development at the National Institute on Drug Abuse: Focus on cocaine. NIDA research monograph, 135, 57–70.
Kiluk, B. D., Carroll, K. M., Duhig, A., Falk, D. E., Kampman, K., Lai, S., Litten, R. Z., McCann, D. J., Montoya, I. D., Preston, K. L., Skolnick, P., Weisner, C., Woody, G., Chandler, R., Detke, M. J., Dunn, K., Dworkin, R. H., Fertig, J., Gewandter, J., … Strain, E. C. (2016). Measures of outcome for stimulant trials: ACTTION recommendations and research agenda. Drug and Alcohol Dependence, 158, 1–7. https://doi.org/10.1016/j.drugalcdep.2015.11.004
Kleykamp, B. A., De Santis, M., Dworkin, R. H., Huhn, A. S., Kampman, K. M., Montoya, I. D., Preston, K. L., Ramey, T., Smith, S. M., Turk, D. C., Walsh, R., Weiss, R. D., & Strain, E. C. (2019). Craving and opioid use disorder: A scoping review. Drug and Alcohol Dependence, 205, 107639. https://doi.org/10.1016/j.drugalcdep.2019.107639
Kreek, M. J., Reed, B., & Butelman, E. R. (2019). Current status of opioid addiction treatment and related preclinical research. Science Advances, 5(10), eaax9140. https://doi.org/10.1126/sciadv.aax9140
Loflin, M. J. E., Kiluk, B. D., Huestis, M. A., Aklin, W. M., Budney, A. J., Carroll, K. M., D’Souza, D. C., Dworkin, R. H., Gray, K. M., Hasin, D. S., Lee, D. C., Le Foll, B., Levin, F. R., Lile, J. A., Mason, B. J., McRae-Clark, A. L., Montoya, I., Peters, E. N., Ramey, T., … Strain, E. C. (2020). The state of clinical outcome assessments for cannabis use disorder clinical trials: A review and research agenda. Drug and Alcohol Dependence, 212, 107993. https://doi.org/10.1016/j.drugalcdep.2020.107993
Montoya, I. D. (2012). Advances in the development of biologics to treat drug addictions and overdose. Adicciones, 24(2), 95–103. https://doi.org/10.20882/adicciones.101
Montoya, I. D. (Ed.). (2016). Biologics to treat substance use disorders. Springer International Publishing. https://doi.org/10.1007/978-3-319-23150-1
Montoya, I. D., Hess, J. M., Preston, K. L., & Gorelick, D. A. (1995). A model for pharmacological research-treatment of cocaine dependence. Journal of Substance Abuse and Treatment, 12(6), 415–421. https://doi.org/10.1016/0740-5472(95)02017-9
Montoya, I. D., & McCann, D. J. (2010). Drugs of abuse: Management of intoxication and antidotes. En A. Luch (Ed.), Molecular, clinical and environmental toxicology. Experientia Supplementum, vol 100, (pp. 519–541). Birkhäuser Basel. https://doi.org/10.1007/978-3-7643-8338-1_15
Montoya, I. D., & Weiss, S. (Eds.). (2018). Cannabis use disorders. Springer International Publishing. https://doi.org/10.1007/978-3-319-90365-1
Rasmussen, K., White D. A., & Acri, J. B. (2019). NIDA’s medication development priorities in response to the Opioid Crisis: Ten most wanted. Neuropsychopharmacology, 44(4), 657–659. https://doi.org/10.1038/s41386-018-0292-5
Ronsley, C., Nolan, S., Knight, R., Hayashi, K., Klimas, J., Walley, A., Wood, E., & Fairbairn, N. (2020). Treatment of stimulant use disorder: A systematic review of reviews. PLOS ONE, 15(6), e0234809. https://doi.org/10.1371/journal.pone.0234809
SAMHSA. (2019). Key substance use and mental health indicators in the United States: Results from the 2018 National Survey on Drug Use and Health (HHS Publication No. PEP19-5068, NSDUH Series H-54). Center for Behavioral Health Statistics and Quality. Substance Abuse and Mental Health Services Administration. https://www.samhsa.gov/data
Skolnick, P., & Volkow, N. D. (2012). Addiction therapeutics: Obstacles and opportunities. Biological Psychiatry, 72(11), 890–891. https://doi.org/10.1016/j.biopsych.2012.08.004
Vandrey, R., & Haney, M. (2009). Pharmacotherapy for cannabis dependence: How close are we? CNS Drugs, 23(7), 543–553. https://doi.org/10.2165/00023210-200923070-00001
Vocci, F., & Ling, W. (2005). Medications development: Successes and challenges. Pharmacology and Therapeutics, 108(1), 94–108. https://doi.org/10.1016/j.pharmthera.2005.06.010
Volkow, N. D. (2020). Collision of the COVID-19 and addiction epidemics. Annals of Internal Medicine, 173(1), 61–62. https://doi.org/10.7326/m20-1212
Yu, E., Miotto, K., Akerele, E., Montgomery, A., Elkashef, A., Walsh, R., Montoya, I., Fischman, M. W., Collins, J., McSherry, F., Boardman, K., Davies, D. K., O’Brien, C. P., Ling, W., Kleber, H., & Herman, B. H. (2008). A Phase 3 placebo-controlled, double-blind, multi-site trial of the alpha-2-adrenergic agonist, lofexidine, for opioid withdrawal. Drug and Alcohol Dependence, 97(1-2), 158–168. https://doi.org/10.1016/j.drugalcdep.2008.04.002