Más allá de la doble hélice
La estructura G-cuádruple del ADN
El ADN es la biomolécula fundamental para el correcto funcionamiento celular y hasta hace poco se ha asociado a la estructura de doble hélice descubierta hace más de sesenta años por Crick, Watson y Franklin. Sin embargo, se han descrito otras estructuras y conformaciones diferentes que el ADN puede adoptar como los G-cuádruples. Estos G-cuádruples se forman en regiones del genoma ricas en guaninas con una estructura tetrámera y controlan procesos biológicos como la expresión genética, la protección contra el envejecimiento o la transmisión de la información neuronal. En este artículo describimos sus características químicas y estructurales además de introducir sus principales funciones celulares. Para finalizar, presentamos los G-cuádruples como dianas moleculares para futuras terapias contra el cáncer.
Palabras clave: G-cuádruple, ADN, telómeros, oncogén, fármaco.
Hoy en día se conoce que los ácidos nucleicos son biomoléculas fundamentales para el correcto funcionamiento celular y la regulación de los procesos biológicos. Estas biomoléculas pueden plegarse en varias estructuras y conformaciones. Sin embargo, la estructura más conocida es la obtenida por Rosalind Franklin, James Watson y Francis Crick en los años cincuenta, la famosa doble hélice del ácido desoxirribonucleico o ADN. El descubrimiento de la estructura de la molécula de la vida revolucionó la biología molecular del siglo XX porque servía para comprender cómo se almacenaba, protegía y transmitiría la información genética de los seres vivos. El ADN es una estructura polimérica helicoidal compuesta por cuatro nucleótidos que se diferencian entre sí por la base nitrogenada que contienen: adenina (A), guanina (G), timina (T) o citosina (C). Así pues, el ADN se puede entender como un código de letras que actúa como guía para la construcción del ácido ribonucleico o ARN, el cual sirve, mayoritariamente, para generar las proteínas que regulan todas las funciones biológicas y características de los seres vivos, como por ejemplo el color de ojos, la forma de los cabellos o el tamaño de las manos.
Además de la estructura en doble hélice, se ha descubierto que el ADN puede formar conformaciones alternativas que controlan varias funciones biológicas, como por ejemplo la expresión génica o la protección contra el envejecimiento. Entre estas estructuras, el ADN G-cuádruple (G4) es la que más atención ha recibido en los últimos diez años a causa de su rol como regulador epigenético y como diana terapéutica de enfermedades como el cáncer. En este artículo queremos introducir a los lectores en esta nueva y magnífica estructura de ADN, tanto en cuanto a la estructura como en cuanto a sus funciones moleculares y biológicas. Además, analizamos sus potenciales aplicaciones como diana terapéutica en varias enfermedades y explicamos las perspectivas futuras de investigación en este campo.
La diversidad estructural del ADN
La carrera por el descubrimiento de la estructura del ADN culminó con los experimentos de difracción de fibras llevados a cabo por Rosalind Franklin, que dieron lugar a la obtención de la famosa Imagen 51 de rayos X. Sin embargo, James Watson y Francis Crick publicaron la descripción de la estructura de la doble hélice en la revista Nature basándose en esta imagen (Watson y Crick, 1953) y años después, en 1962, ambos, junto con Maurice Wilkins, fueron galardonados con el premio Nobel de Fisiología y Medicina (Oregon State University, 2015). Este descubrimiento se convirtió en el avance más significativo y extraordinario de la biología molecular y uno de los hallazgos científicos más importantes del siglo XX.
La estructura de doble hélice de ADN se compone de dos cadenas enfrentadas entre sí de forma antiparalela formando una espiral que crea una estructura helicoidal. Como ya se ha comentado antes, las cadenas de ADN se forman a partir de cuatro unidades distintas, los nucleótidos. Los nucleótidos incluyen un grupo fosfato, un azúcar y una base nitrogenada. Las bases nitrogenadas son la adenina, guanina, timina y citosina. En cuanto a los grupos fosfatos, estos se orientan hacia el exterior de la estructura, mientras que las bases se alojan en el interior, y dan lugar a pares de bases enfrentadas (guanina-citosina y adenina-timina) que se encuentran unidas por enlaces de hidrógeno. Cada par de bases se coloca encima de otro con una rotación determinada. Así se forma la espiral en el eje central de la estructura y que muchos artistas, escultores y arquitectos han utilizado para crear sus obras. Además, hay que comentar que cada una de las cadenas de un ácido nucleico tiene dos extremos a los que nos referimos como extremo 5’ y extremo 3’. Así, podemos asignar una orientación o direccionalidad del extremo 5’ al extremo 3’ para describir los procesos que ocurren en el ADN.
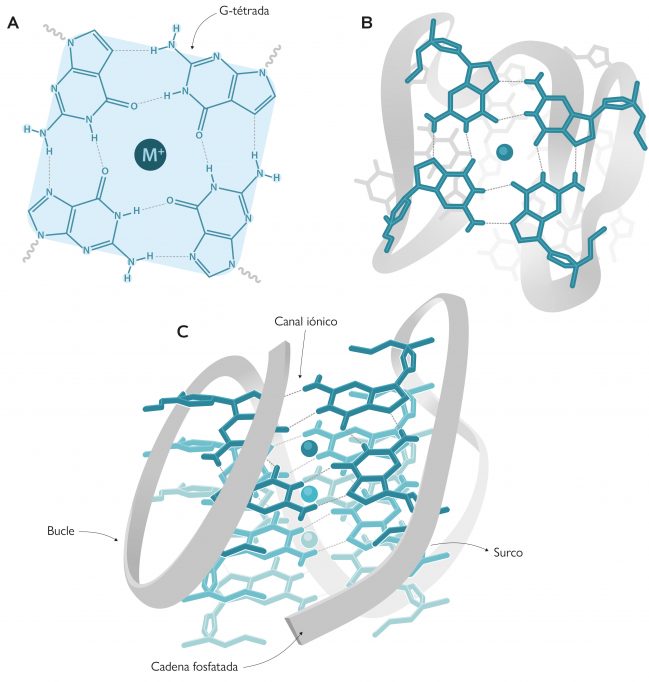
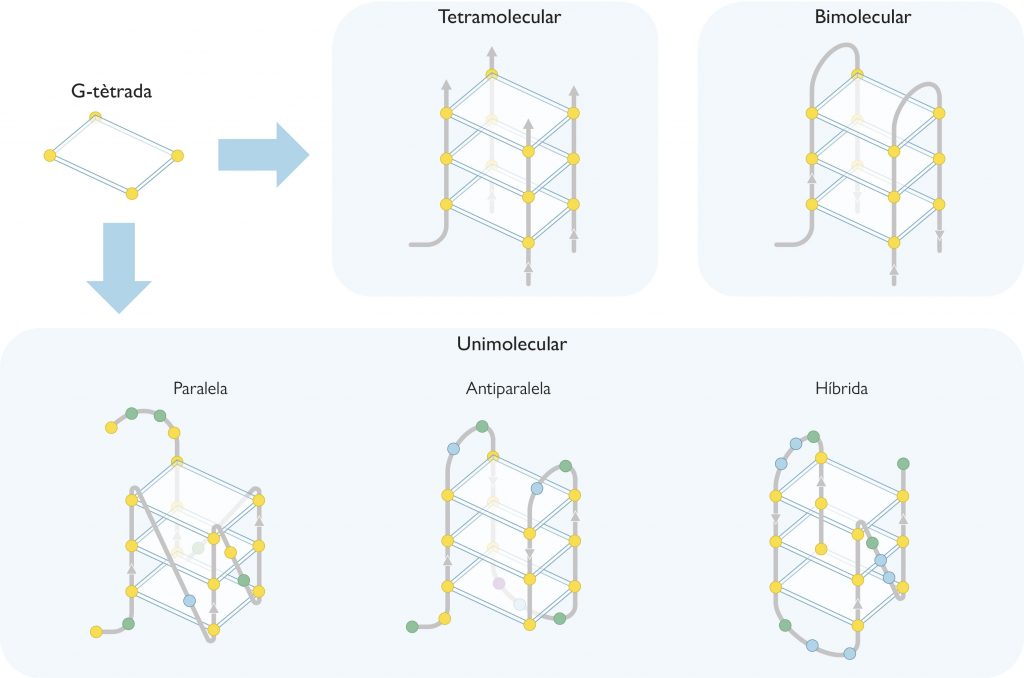
Sin embargo, la estructura en doble hélice no es la única que se conoce en la actualidad para el ADN. Hay otras formas no canónicas, como por ejemplo los ADN-triples (ADN de triple cadena), los i-motif (parecidos a los G-cuádruples) o las horquillas de replicación, que hacen del ADN una molécula con una gran variedad conformacional. De hecho, unos diez años más tarde del desciframiento de la estructura del ADN, Martin Gellert, David R. Davies y colaboradores publicaron las primeras estructuras compuestas por geles de guaninas que formaban G-tétradas (Gellert et al., 1962), las unidades básicas del G-cuádruple. Estas G-tétradas, denominadas también G-quartets, contienen cuatro guaninas unidas por enlaces de hidrógeno, que adoptan una disposición plana (Figura 1a-b). Pero no fue hasta los años ochenta cuando Elizabeth H. Blackburn y su equipo describieron la primera estructura G-cuádruple formada por secuencias de ADN en los telómeros (Henderson et al., 1987). Este descubrimiento despertó un gran interés en la comunidad científica, no solo por la estructura en sí, sino por sus implicaciones biológicas. Esto hizo que rápidamente aumentara el número de estudios para averiguar qué regiones del genoma humano podían formar estas estructuras. Mediante técnicas bioinformáticas y el análisis de secuenciación genómica se localizaron 700.000 regiones en el genoma humano que podrían formar G-cuádruples (Chambers et al., 2015). Pero lo más extraordinario de todo es que no se localizaban al azar, como era de esperar de una región sin funcionalidad, sino que se detectaban principalmente en los telómeros y en los promotores de oncogenes. Este hecho indica que los G-cuádruples tienen un papel primordial en los seres vivos. Como dijo Aaron Klug, premio Nobel de Química por desarrollar métodos cristalográficos para descifrar los complejos proteicos con ácidos nucleicos, «si los G-cuádruples se forman tan fácilmente in vitro, la naturaleza tiene que haber encontrado una forma de utilizarlos in vivo».
La estructura del G-cuádruple
Como ya hemos apuntado antes, los G-cuádruples están formados por anillos de cuatro guaninas unidas por enlaces de hidrógeno que adoptan una disposición plana conocida como G-tétrada. Cada G-cuádruple contiene dos o más G-tétradas que se apilan de forma similar a las plantas de un edificio en el interior del cual se crea una especie de ojo de escalera (un canal iónico) que contiene cationes, normalmente de sodio o potasio (Figura 1). Dependiendo del tamaño del catión, este se sitúa en la misma planta del edificio (es decir, en el mismo plano que cada G-tétrada) y forma cuatro enlaces con las guaninas, como ocurre en el caso del sodio; el potasio, en cambio, es más grande y se coloca entre dos plantas del edificio (es decir, entre dos G-tétradas) y forma ocho enlaces (Neidle y Balasubramanian, 2006).
Los G-cuádruples pueden presentar multitud de conformaciones que vienen regidas por varios parámetros. Así pues, pueden estar formados por una (cuádruple unimolecular), dos (bimolecular) o cuatro (tetramolecular) cadenas de ADN ricas en guaninas (Figura 2). Según la orientación relativa de estas cadenas también existen varias conformaciones, como por ejemplo la paralela, la antiparalela y la híbrida (Figura 2). En la conformación paralela todas las cadenas tienen la misma orientación, mientras que en la antiparalela, dos presentan una orientación opuesta a las otras. En cuanto a la conformación híbrida, tres cadenas se orientan en un sentido y la restante, en el opuesto. Por otro lado, estas cadenas de ADN forman bucles y surcos en los G-cuádruples (Figura 1c), que dependen de la composición de nucleótidos de las cadenas y otros factores externos, como pueden ser la fuerza iónica o la temperatura.
El G-cuádruple en los telómeros
Los telómeros se encuentran en los extremos de los cromosomas, los cuales están compuestos por regiones de ADN no codificante de secuencias altamente repetitivas. Tienen una función esencial para mantener la integridad de los cromosomas en procesos como la recombinación genética, la fusión de cromosomas y la degradación por nucleasas. En definitiva, los telómeros conservan la información génica durante las divisiones celulares y, por lo tanto, preservan la integridad y funcionalidad de los genes en el tiempo. Concretamente, el ADN telomérico está compuesto por una repetición de nucleótidos rica en guaninas, que normalmente es TTAGGG para las células eucariotas, y que presenta una longitud de entre 9.000 a 15.000 nucleótidos. A pesar de que el ADN telomérico presenta una conformación de doble hélice, en su extremo 3’ siempre existe un fragmento de ADN monocatenario de entre 50 y 300 bases de longitud, que sobra respecto a su cadena complementaria (Figura 3).
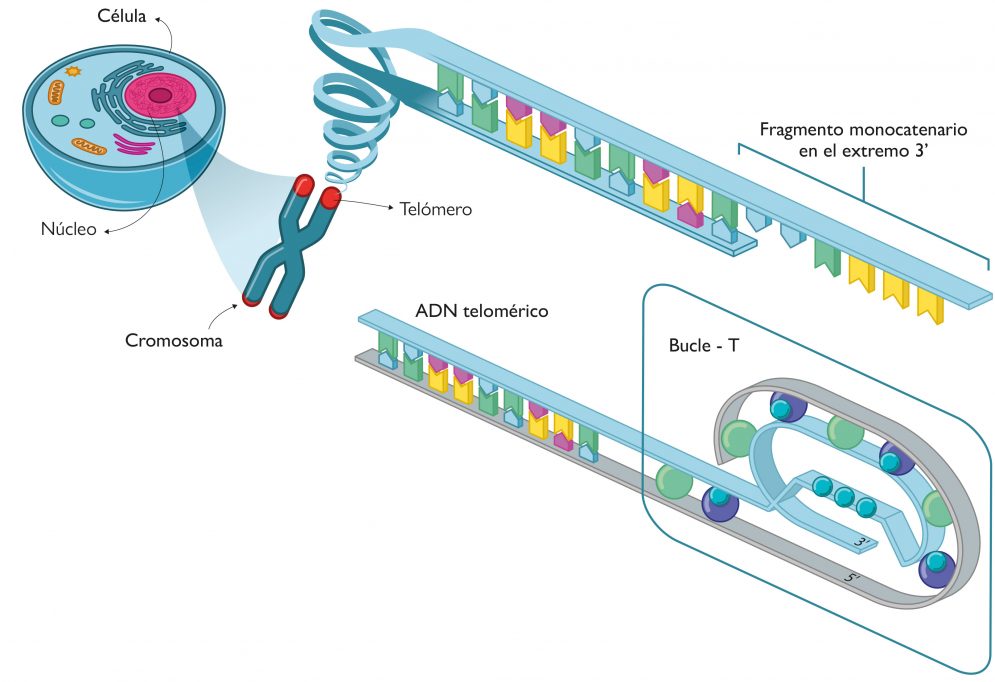
El ADN monocatenario en los telómeros forma una estructura en forma de bucle (conocida como bucle-T), en el que el ADN se enrosca sobre sí mismo y al cual se unen una serie de proteínas. Esta estructura proteica se denomina supercomplejo shelterina o telosoma y protege a los telómeros de la degradación propia del ADN que está desbridado en los extremos porque se encuentra en forma monocatenaria sin emparejarse con la cadena complementaria (Figura 3). A pesar del importante papel que los telómeros tienen en la protección de los cromosomas, estos se acortan en cada división celular a causa del conocido «problema de la replicación», que concluye con la muerte celular. Según el mecanismo de replicación típico del ADN, la enzima polimerasa requiere un pequeño fragmento de ARN, llamado cebador, que actúa como iniciador para añadir nucleótidos a la cadena nueva de ADN que se forma. Como la adición siempre es en dirección 5’ a 3’, una de las dos cadenas se sintetiza de forma continua, mientras que la otra tiene que construirse de forma discontinua con fragmentos cortos de ADN llamados fragmentos de Okazaki, cada uno de los cuales tiene su propio cebador que sirve como molde para iniciar la adición de nucleótidos en la dirección 5’ a 3’. Al finalizar, los fragmentos de ARN son eliminados y sustituidos por ADN, con la excepción del último cebador, el del extremo 5’. Este es precisamente «el problema» y el origen del fragmento monocatenario 3’ de los telómeros. Consiguientemente, en cada ciclo celular se produce una pérdida neta de nucleótidos de entre 100 a 200 bases. Después de un determinado número de ciclos, se llega al conocido como límite Hayflick, donde la longitud de los telómeros es tan corta que ni se puede formar el bucle-T ni tampoco se puede producir otro ciclo. En este punto, la célula tiene asociada una gran inestabilidad genómica y entra en la etapa de senescencia, en la cual se para la división y, en última instancia, se produce la muerte celular.
Así pues, la longitud de los telómeros se asocia al envejecimiento y a la edad biológica celular, que puede ser diferente de la edad cronológica del individuo. Entonces, células con telómeros largos son consideradas jóvenes y pueden dar lugar a un elevado número de divisiones, mientras que las células con telómeros cortos se duplican poco y están cerca de morir. Existe una relación directa de los telómeros con ciertos aspectos del estilo de vida, como por ejemplo los altos niveles de estrés o las dietas poco equilibradas. Además, también están relacionados estrechamente con enfermedades asociadas a la edad, como por ejemplo el cáncer, las enfermedades cardiovasculares o las neurodegenerativas como el Alzheimer. Este fenómeno también suscita un gran interés entre el público general. De hecho, hay libros que proporcionan consejos para mantener la longitud telomérica con el propósito de mejorar la calidad de vida. Incluso hay empresas dedicadas a medir la longitud de los telómeros con el objetivo de estimar una edad biológica real, como por ejemplo LifeLenght® o TeloYears®.
Pero los sistemas biológicos han desarrollado un mecanismo general para el problema de acortamiento telomérico: la enzima telomerasa. Esta enzima es responsable del mantenimiento de la longitud de los telómeros, y es capaz de sintetizar ADN a partir de un molde de ARN. Su descubrimiento se atribuye a Carol Greider, Elisabeth Blackburn y Jack Szostak, los cuales fueron galardonados con el Premio Nobel de Medicina en 2009. La telomerasa es un complejo enzimático formado por varios componentes: diferentes grupos proteicos, una proteína de transcripción inversa y un molde de ARN, complementario del extremo 3’ telomérico. En la regulación de este proceso intervienen varios factores, y no en todas las células la telomerasa está activada. Concretamente, la mayoría de las células de los seres vivos son somáticas y se produce un acortamiento progresivo de sus telómeros, mientras que en células especiales como las embrionarias, madre y epiteliales, la telomerasa sí que se encuentra activada.
Ahora bien, la telomerasa está sobreexpressada en aproximadamente el 90 % de las células que se relacionan con la proliferación incontrolada de los tumores y inmortalización de sus células. Las células inmortalizadas se dividen de manera indefinida porque han evadido los mecanismos naturales de muerte celular, como por ejemplo las células cancerígenas, contrariamente a las células normales, que proliferan un número finito y reducido de veces. Precisamente por este motivo la telomerasa se considera una atractiva diana terapéutica para el tratamiento del cáncer. De hecho, actualmente existe una amplia área de investigación focalizada en el diseño de moléculas que, mediante la estabilización de estructuras G-cuádruple en los telómeros, actúan como inhibidores de la telomerasa y consiguen frenar los procesos tumorigénicos.
El G-cuádruple en los promotores de los oncogenes
Los análisis bioinformáticos y de secuenciación masiva de ADN han permitido localizar las secuencias formadoras del G-cuádruple en los promotores de multitud de genes que producen cáncer, los llamados oncogenes. Al contrario de los telómeros, los promotores son siempre fragmentos de ADN de doble cadena, lo que a priori hace pensar que es más difícil la formación de la estructura del G-cuádruple. Pero los procesos de transcripción génica requieren el desbridamiento previo de la doble hélice de ADN, lo que facilita la formación de los G-cuádruple. Una vez se desbrida el ADN, la estructura G-cuádruple puede formarse a partir de la cadena rica en guaninas. Esto se puede producir mediante la acción de determinadas proteínas y pequeñas moléculas que regulan la expresión de los oncogenes (Danzhou y Keika, 2010). Se ha demostrado que hay moléculas que estabilizan los G-cuádruples en los promotores de los oncogenes y, por tanto, obstaculizan su transcripción, con la consiguiente inhibición de las oncoproteínas y finalmente, la curación del cáncer. Así pues, la formación de los G-cuádruples en los promotores de los oncogenes mediante pequeñas moléculas obtenidas en el laboratorio también es una estrategia para tratar el cáncer.
Se han descubierto muchas secuencias formadoras del G-cuádruples en los promotores de oncogenes a pesar de que son tres los que ocupan la mayoría de trabajos por su importancia en la inicialización y en el desarrollo del cáncer. Estos tres son los oncogenes del factor de transcripción c-Myc, las proteínas reguladoras mitocondriales Bcl-2 y los receptores tirosina-quinasa c-Kit.
El primer oncogén con un G-cuádruple en el promotor que se identificó fue el gen del c-Myc. La proteína c-Myc contribuye a la regulación de aproximadamente el 15 % de los genes del genoma humano; por lo tanto, está estrechamente relacionada con la muerte celular programada o apoptosis, el metabolismo, la proliferación y, en general, el control del ciclo celular. Cuando el c-Myc se sobreexpresa, tiene lugar una alteración de los procesos de regulación mencionados y la activación de otros genes que promueven diferentes tipos de cánceres, como por ejemplo el de mama, de colon o cerebral. La región de ADN en el promotor del c-Myc contiene una secuencia de 27 pares de bases rica en guanina, la cual da lugar a la formación de una estructura G-cuádruple paralela. Sabemos que esta región controla la actividad transcripcional del c-Myc y, como se ha mencionado, la formación del G-cuádruple supone un obstáculo para la transcripción de los oncogenes.
«Se han desarrollado varias moléculas G-cuádruple a partir de extractos naturales o sintetizadas en el laboratorio que han resultado muy prometedoras en terapias del cáncer»
Por otro lado, el gen Bcl-2 presenta una región rica en guaninas en su promotor que también regula su expresión y que puede formar una estructura G-cuádruple híbrida con un bucle muy largo. El producto proteico del oncogén Bcl-2 es una proteína mitocondrial que está relacionada con el control de la muerte celular, puesto que funciona como inhibidor de la apoptosis de las células cancerígenas. Se ha demostrado que esta proteína está sobreexpresada en multitud de cánceres, como por ejemplo el de mama, el de próstata, el de pulmón, el de colon, el cervical o el linfático. Así pues, la estabilización del G-cuádruple en el promotor de Bcl-2 podría inducir la apoptosis celular y, por tanto, curar el cáncer.
En cuanto al gen c-kit, su promotor presenta dos regiones ricas en guaninas, conocidas como c-kit1 y c-kit2. Se trata de secuencias de 22 y 20 pares de bases respectivamente, próximas al lugar de iniciación de la transcripción del oncogén y, por tanto, al inicio del cáncer. Ambas pueden formar estructuras G-cuádruple que tienen topologías diferentes. La secuencia c-kit1 forma un cuádruple paralelo con un gran bucle estabilizado por interacciones entre pares de bases de la misma secuencia. En cambio, el G-cuádruple formado en el c-kit2 presenta una topología paralela más convencional. En este caso, el c-kit codifica un receptor transmembrana que estimula la proliferación y la diferenciación celular. Se ha demostrado que este gen está estrechamente relacionado con numerosos tipos de tumores, como por ejemplo de los nódulos linfáticos o de los pulmones, y especialmente con el cáncer gastrointestinal. Como las regiones ricas en guaninas del promotor de c-kit son esenciales para su transcripción, la estabilización y la formación de sus G-cuádruples tendría un papel fundamental en la inactivación de la expresión en células tumorales.
El G-cuádruple se forma también en el ARN
Todos los ejemplos mencionados hasta ahora se corresponden al ADN G-cuádruple, pero el ARN también puede dar lugar a estructuras tetrámeras de G-cuádruple. El ARN, al ser monocatenario, tiene mucha más capacidad para formar estructuras secundarias no canónicas in vivo en comparación a la que presenta el ADN. Como en el caso del ADN cuádruple, también se ha demostrado la existencia de secuencias en el ARN mensajero que forman las estructuras cuádruples en las células. La formación o no formación del ARN cuádruple altera el transcriptoma de las células y, por tanto, influye en sus funciones biológicas. De todas formas, las investigaciones de los G-cuádruples en el ARN apenas han empezado y todavía se desconoce con qué funciones están relacionados.
El G-cuádruple en el futuro
En la actualidad, el ADN es una de las principales dianas moleculares para terapias contra el cáncer, como por ejemplo los tratamientos con el fármaco cisplatino, que representa más del 90 % de los tratamientos oncológicos actuales. Los derivados del platino como este fármaco interaccionan con la doble hélice del ADN, aunque con poca selectividad entre células tumorales y no tumorales. Así pues, tienen multitud de efectos secundarios adversos, además de la posible resistencia adquirida después del tratamiento. Por tanto, muchas investigaciones actuales se centran en el diseño de nuevos fármacos dirigidos hacia dianas terapéuticas alternativas, como por ejemplo el ADN G-cuádruple. Como se ha mencionado anteriormente, estas intrigantes estructuras se forman en posiciones muy específicas del genoma, como por ejemplo el ADN en los telómeros y en los promotores de oncogenes.
Hoy en día, la industria farmacéutica y los laboratorios académicos han desarrollado varias moléculas G-cuádruple a partir de extractos naturales o sintetizadas en el laboratorio y que han resultado muy prometedoras en terapias del cáncer (Neidle, 2017; Pont et al., 2020). Hay varias moléculas en estudios clínicos como el Quarfloix, que ha demostrado ser un eficiente fármaco contra el cáncer de hígado, uno de los más agresivos y con una alta tasa de letalidad. El Quarfloxin estabiliza y forma un G-cuádruple ribosómico que inhibe la prolongación de la polimerasa y muestra una potente actividad antitumoral.
Por otro lado, algunos estudios ponen de relieve el importante papel que las estructuras g-cuádruple tienen en diferentes procesos biológicos, a pesar de que los mecanismos exactos y sus repercusiones todavía no están del todo muy definidos. Por ejemplo, se conoce que el G-cuádruple tiene también implicaciones en varios procesos neurodegenerativos. Consiguientemente, un gran número de grupos de investigación se focalizan en el diseño de tratamientos para estas enfermedades empleando el cuádruple como elemento regulador. En conclusión, nos encontramos ante una época emocionante para trabajar y para averiguar cómo funcionan estas estructuras G-cuádruple, ya que pueden ser el punto clave para tratar dolencias como por ejemplo el cáncer o las enfermedades neurodegenerativas.
Referencias
Chambers, V. S., Marsico, G., Boutell, J. M., Di Antonio, M., Smith, G. P., & Balasubramanian, S. (2015). High-throughput sequencing of DNA G-quadruplex structures in the human genome. Nature Biotechnology, 33(8), 877–881. https://doi.org/10.1038/nbt.3295
Danzhou, Y., & Keika, O. (2010). Structural insights into G-quadruplexes: Towards new anticancer drugs. Future Medicinal Chemistry, 2(4), 619–646. https://doi.org/10.4155/fmc.09.172
Gellert, M., Lipsett, M. N., & Davies, D. R. (1962). Helix formation by guanylic acid. Proceedings of the National Academy of Sciences, 48(12), 2013–2018. https://doi.org/10.1073/pnas.48.12.2013
Henderson, E., Hardin, C. C., Walk, S. K., Tinoco, I., & Blackburn, E. H. (1987). Telomeric DNA oligonucleotides form novel intramolecular structures containing guanine-guanine base pairs. Cell, 51(6), 899–908. https://doi.org/10.1016/0092-8674(87)90577-0
Neidle, S. (2017). Quadruplex nucleic acids as targets for anticancer therapeutics. Nature Reviews Chemistry, 1(5), 0041. https://doi.org/10.1038/s41570-017-0041
Neidle, S. & Balasubramanian, S. (eds.). (2006). Quadruplex nucleic acids. Royal Society of Chemistry.
Oregon State University. (2015). Linus Pauling and the race for DNA: A documentary history. Consultat el 2 de maig de 2020. http://scarc.library.oregonstate.edu/coll/pauling/dna/index.html
Pont, I., Martínez-Camarena, A., Galiana-Roselló, C., Tejero, R., Albelda, M. T., González-García, J., Vilar, R., & García-España, E. (2020). Development of polyamine-substituted triphenylamine ligands with high affinity and selectivity for G-quadruplex DNA. ChemBioChem, 21(8), 1167–1177. https://doi.org/10.1002/cbic.201900678
Watson, J. D., & Crick, F. H. C. (1953). Molecular structure of nucleic acids: A structure for deoxyribose nucleic acid. Nature, 171, 737–738. https://doi.org/10.1038/171737a0