Próxima parada: Lenguaje
El viaje del gen FOXP2 a través del tiempo

¿Cómo evolucionó el lenguaje en el ser humano? El registro fósil no ofrece pruebas suficientes para reconstruir su evolución y los animales no hablan. Pero a medida que se van desvelando sus sustratos moleculares y neurales, su origen y función se pueden abordar de forma comparativa en otras especies. Esto es lo que ocurre con FOXP2, un gen estrechamente relacionado con el lenguaje que es esencial para el aprendizaje en ratones, aves e incluso moscas. La comparación del papel del gen FOXP2 en humanos y en otros animales está comenzando a revelar principios comunes que podrían haber proporcionado elementos fundamentales para la evolución del lenguaje.
Palabras clave: habla, lenguaje, aprendizaje sensomotor, evo-devo, homología profunda.

Figura 1. ¿Qué le resultaría más interesante a un científico extraterrestre que aterrizara en el planeta Tierra? / Peter Schatton
El lenguaje es universal
Imagine que es un científico extraterrestre que estudia la conducta y que aterriza en nuestro planeta por primera vez (figura 1). ¿Qué le sorprendería más? ¿Las enormes ballenas y las pequeñas moscas de la fruta, atareadas alimentándose y reproduciéndose de formas muy diferentes? ¿O le fascinarían los simios bípedos con ropa que ocupan hábitats muy distintos a lo largo del globo, parecen muy diversos y hablan entre ellos con cadenas de sonidos muy diferentes, pero que aun así son parte de la misma especie, Homo sapiens? Si miramos más de cerca, veremos que estas cadenas de sonidos diferentes, que llamamos lenguas, son, de hecho, fundamentalmente universales: todas las sociedades humanas tienen su propia lengua.
Aunque suenen distintas, todas las lenguas comparten algunas similitudes. Todos los idiomas se estructuran de forma jerárquica. Los elementos fundamentales son los sonidos que los humanos pueden generar sin esfuerzo con su voz, como p, b, f, v, t, d, a, e y otros. Se combinan en un repertorio más amplio de sílabas con las que se pueden componer miles de palabras diferentes. Las normas gramaticales, que también son parcialmente similares en todos los idiomas, permiten hilar combinaciones casi infinitas de palabras para construir frases que pueden expresar un número aparentemente ilimitado de acciones y pensamientos. Lo mismo se aplica a las lenguas de signos, en las que un repertorio limitado de gestos y movimientos faciales se combina para formar un repertorio mayor de gestos que a su vez, gracias a su gramática, forman oraciones con significado.
Nuestro científico extraterrestre estudioso de la conducta podría pensar: «¡Qué sistema tan ingenioso!» Pero, ¿por qué comparten principios comunes lenguas tan diferentes?
«A partir de unas pocas semanas después del nacimiento, los niños pueden distinguir los sonidos del habla de otros sonidos»
Contribuciones genéticas al lenguaje
El hecho de que todos los humanos utilicen el lenguaje y que todas las lenguas compartan algunas características ha sugerido a los lingüistas y biólogos que debe existir un componente genético importante. El componente genético del lenguaje, llamado «instinto del lenguaje» en el título del libro publicado en 1994 por Steven Pinker, debe estar relacionado con la capacidad de «aprender» la lengua, puesto que la composición genética de un bebé no afecta a qué lengua concreta hablará; un bebé nacido de padres de habla hispana pero adoptado y criado por padres de habla francesa aprenderá francés, no español. Entonces, ¿cómo tiene lugar este proceso de aprendizaje? Primero, el cerebro del bebé tiene que identificar qué sonidos son parte de la lengua. Unas pocas semanas después del nacimiento, los niños pueden distinguir los sonidos del habla de otros sonidos y pueden incluso relacionar una sílaba al oírla con la cara que ha producido el sonido (Kuhl y Meltzoff, 1982). Cuando un bebé comienza a balbucear a los pocos meses de edad, tiene que modificar sus balbuceos para ajustarlos a la lengua de su entorno. Este proceso continúa durante los primeros dos años de vida. En paralelo, el bebé aprende –sin esfuerzo y sin instrucción formal– el significado de los sonidos y las normas que gobiernan la forma en que se combinan. Incluso antes de que los pequeños puedan hablar bien, ya conocen la diferencia de significado cuando sus padres preguntan «¿Le has quitado el juguete a María?» o «¿María te ha quitado tu juguete?». Conforme los niños crecen sus cerebros también reaccionan de forma distinta a oraciones que son semánticamente correctas o incorrectas («Mi tío verá la película» frente a «Mi tío soplará la película»), y también diferencian entre oraciones sintácticamente correctas e incorrectas («Mi tío verá/viendo la película») (Friederici, 2006).
«Si los bebés nacen con un instinto para el aprendizaje lingüístico, ¿cómo se fija esto en sus genes? ¿Necesitan genes “especializados”? ¿O el aprendizaje lingüístico solo es un proceso más de aprendizaje?»
«¡Oh!», dice el extraterrestre, «parece que estos bebés de Homo sapiens nacen siendo pequeñas máquinas de aprender lenguaje. ¿Cómo lo hacen?»
FOXP21
Si los bebés nacen con un instinto para el aprendizaje lingüístico, ¿cómo se fija esto en sus genes? ¿Necesitan genes «especializados» que únicamente son relevantes para el habla o el lenguaje? ¿O el aprendizaje lingüístico solo es un proceso más de aprendizaje, como aprender a andar, a montar en bicicleta o matemáticas? La segunda opción parecía la más probable porque las enfermedades genéticas que afectan al lenguaje también suelen afectar otros dominios cognitivos. Por eso el diagnóstico de un «trastorno específico del lenguaje» que no implicaba otras anomalías morfológicas o mentales en una familia británica sorprendió a la comunidad científica. Parece que la abuela de la familia conocida como KE tenía una mutación espontánea que fue heredada por cuatro de sus cinco hijos e hijas y diez de sus 24 nietos y nietas. El patrón hereditario es característico de una mutación dominante en uno de los cromosomas no sexuales (autosomas). En el caso de la familia KE, los miembros afectados tienen problemas al coordinar la lengua y los músculos de la boca para producir sonidos del habla. Por ejemplo, repetir cadenas polisilábicas sin sentido como «woogalamic» o «perplisteronk» es mucho más complicado para un miembro de la familia KE con la mutación que para un familiar no afectado (Watkins, Dronkers y Vargha-Khadem, 2002). Además, la comprensión gramatical también está afectada, aunque en menor medida que la producción del habla. Por ejemplo, cuando se les pedía que señalaran la imagen que corresponde al texto «La liebre que persigue al caballo es roja», los miembros de la familia afectados cometían más errores (figura 2).
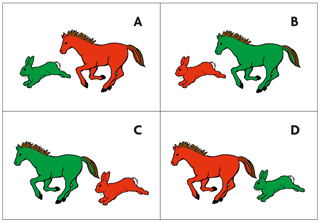
Figura 2. Imagen basada en el test TROG (test de recepción de gramática, Bishop, 1983). Los miembros afectados de la familia KE fallaban más cuando se les pedía que señalaran la imagen adecuada para el texto: «La liebre que persigue al caballo es roja.» / Adriana Schatton
Como los problemas de comprensión y producción de lenguaje complejo afectan a la educación y la interacción con otros, la mutación representa un hándicap enorme para los miembros afectados de la familia. Al mismo tiempo, el caso fue para la comunidad científica una ventana a los cimientos moleculares de la producción y percepción lingüística, y proporcionó la esperanza de una posible intervención clínica (Vargha-Khadem, Gadian, Copp y Mishkin, 2005). La cartografía genética reveló que todos los miembros afectados de la familia KE tenían una mutación en un gen del cromosoma 7 llamado Forkhead box P2, o FOXP2 (Lai, Fisher, Hurst, Vargha-Khadem y Monaco, 2001). El curioso nombre, forkhead box (“dominio de cabeza de tenedor”), lo acuñó en 1989 un grupo de científicos que trabajaba con la mosca de la fruta. Identificaron mutantes con «cabeza de horquilla» (forked head en lengua inglesa) y conectaron el fenotipo con una sección particular del ADN. Este dominio existe en más de cuarenta genes organizados en 19 familias que reciben nombres que van desde FoxA hasta FoxS. Todos ellos codifican proteínas, llamadas «factores de transcripción», que regulan la función de otros genes. La parte forkhead box del factor de transcripción se une a regiones reguladoras específicas de otros genes, llamados «genes diana», e incrementan o disminuyen su actividad. Muchos factores de transcripción con dominios forkhead están relacionados con la salud y la enfermedad, pero solo la familia de genes P se ha relacionado con el habla y el lenguaje.
El científico extraterrestre se rasca sus propias «antenas en forma de horquilla» y se pregunta: «¿Si yo tuviera un gen FOXP2 podría hablar como Homo sapiens?»
«El descubrimiento del FOXP2 abrió la puerta a la posibilidad de responder muchas preguntas sobre
la conexión entre genes y lenguaje»
¿Un gen para cada rasgo?
El descubrimiento del FOXP2 abrió la puerta a la posibilidad de responder muchas preguntas sobre la conexión entre genes y lenguaje. ¿Tener un gen FOXP2 nos da el lenguaje? No. El FoxP2 existe en muchas especies que no hablan. La importancia de este gen para el desarrollo pulmonar en ratones ya se había descrito incluso antes de que su mutación en la familia KE se relacionara con el lenguaje, y mostró que el FoxP2 no era ni un gen exclusivamente humano ni exclusivamente relacionado con el cerebro. Los genes exclusivamente humanos existen (Dennis et al., 2012) pero FoxP2 no es uno de ellos. FoxP2 existe en los 274 vertebrados estudiados hasta ahora y se encuentra entre los genes cuya secuencia apenas ha cambiado en la evolución de los vertebrados. Esto sugiere que la función del gen FoxP2 podría no haber cambiado mucho de peces a humanos, por lo que sea cual sea la función exacta de este gen, existe una presión evolutiva para conservar su secuencia. Esta idea se ve reforzada por el descubrimiento de que las mutaciones del FOXP2 identificadas en humanos –a día de hoy son 23 mutaciones distintas y todas ellas afectan al habla y el lenguaje– nunca afectan a las dos copias del gen (alelos), lo cual implica que cuando las dos copias han mutado, el embrión no puede sobrevivir. Esto sucede también en ratones con mutaciones en ambos alelos del gen Foxp2: mueren pocas semanas después del nacimiento, al parecer por trastornos pulmonares. Los murciélagos son una excepción a la extendida conservación del FoxP2 en los vertebrados. Muchas especies de murciélagos tienen una secuencia FoxP2 muy divergente. Esto es un descubrimiento enigmático que todavía espera una explicación (revisado en Knörnschild, 2014).
Al extraterrestre, esto le parecería un poco confuso. ¿Las mutaciones FOXP2 causan un déficit en un rasgo exclusivamente humano, pero prácticamente la misma versión del FoxP2 existe en todos los vertebrados?
De ratones y hombres
cial después de todo, Wolfgang Endard y sus colegas del Instituto Max Planck de Antropología Evolutiva en Leipzig informaron de que, pese a que la secuencia de la proteína FOXP2 en humanos era en conjunto muy similar a la FoxP2 en el resto de vertebrados, la variante humana había cambiado más de lo esperado en la historia (evolutiva) reciente. Además, todos los humanos tienen esta versión de FOXP2 específicamente humana desde hace unos 200.000 años, coincidiendo aproximadamente con la aparición de los humanos anatómicamente modernos, aunque el momento exacto es controvertido. La noción de que la versión exclusivamente humana de esta proteína fue importante para la evolución humana fue recibida con escepticismo porque la secuencia difería de la versión de los chimpancés solo en dos de los 714 aminoácidos, los elementos constitutivos de las proteínas. ¿Podían solo dos aminoácidos ser la razón por la que nosotros hablamos y los chimpancés no? Por otro lado, el descubrimiento de una versión de FOXP2 específica en humanos que parecía ser beneficioso mantener y que, por lo tanto, estaba presente en toda la población humana requería más investigación. Para ello, los científicos de Leipzig diseñaron un ingenioso experimento: añadieron experimentalmente el gen humano FOXP2 a ratones y comprobaron si esos ratones eran diferentes a sus hermanos no manipulados (Enard et al., 2009). No fue ninguna sorpresa, pero los ratones no desarrollaron el lenguaje, probando que la versión humana de FOXP2 no puede, por sí sola, desencadenar los cambios necesarios en el cerebro y el aparato vocal para desarrollar el habla y el lenguaje.
«Cuando se separó de sus madres a las crías de ratón que tenían la versión del FOXP2 humana, realizaron llamadas de auxilio con características bioacústicas diferentes a las de las crías no manipuladas»
Dadas las diferencias entre los cerebros y las estructuras generadoras de sonido de un ratón y un humano, era, por supuesto, muy poco probable que un único gen pudiera activar tal programa. No obstante, el experimento de introducir el gen humano FOXP2 en un ratón fue informativo; cuando se separó de sus madres a las crías que tenían la versión del FOXP2 humana, realizaron llamadas de auxilio con características bioacústicas diferentes a las de las crías no manipuladas, lo que supone otra conexión entre FOXP2 y las vocalizaciones. Todavía no se conocen los sustratos neurales para estos cambios de vocalización, pero diversos experimentos posteriores han mostrado que los cerebros de ratones expuestos a la versión humanizada de FOXP2 son diferentes estructural y funcionalmente de los cerebros de ratones con Foxp2 de ratón. La investigación posterior de los laboratorios de Ann Graybiel, Simon Fisher y Wolfgang Enard estableció que los cerebros de ratones a los que se había alterado experimentalmente para portar una mutación equivalente a la de la familia KE también muestran diferencias con los ratones comunes. Curiosamente, parece que en los ratones algunas de las consecuencias neurales y conductuales de tener un alelo Foxp2 con una mutación similar a la que produce trastornos del lenguaje en humanos son opuestas a aquellas presentes en ratones con la versión humanizada del gen. Estos últimos también difieren de los ratones de camadas normales en tareas de resolución de laberintos. Cuando los ratones tienen que pasar de encontrar el camino basándose en señales visuales (como ver una estrella) a encontrar el camino girando a la izquierda o a la derecha, aquellos con una versión humana de FOXP2 muestran una transición más rápida de una estrategia a la otra. Los autores sugieren que el aprendizaje lingüístico requiere un cambio similar entre estilos de aprendizaje.
Juntos, estos resultados ponen de relieve que pequeños cambios en la secuencia de un gen muy conservado podrían cambiar la función neural, pero que los rasgos de conducta o las adaptaciones morfológicas únicos no necesitan genes únicos. Más bien son combinaciones concretas de grupos de genes los que pueden actuar en conjunto y provocar efectos «únicos». De hecho, desde el descubrimiento original sobre la relación entre mutaciones del FOXP2 y el trastorno específico del lenguaje, se han identificado más genes implicados en diferentes trastornos relacionados con el lenguaje. Es probable que algunos de estos genes actúen junto al FOXP2 en una red molecular. Por ejemplo, otro miembro de la familia genética FoxP, FOXP1, también está relacionado con déficits del lenguaje y las proteínas FoxP1 y FoxP2 pueden interactuar directamente (Graham y Fisher, 2015).
El científico extraterrestre grita: «¡Qué idea más buena introducir la versión humana de un gen en ratones!» Y se pregunta por qué se produjeron cambios neurales y de comportamiento en esos ratones, aunque no empezaran a hablar…
Formación de circuitos versus función de circuitos
¿Afectó la versión humana del FOXP2 al desarrollo cerebral de los ratones? ¿O la manipulación genética afectó a la función cerebral después de que se completara el desarrollo? ¿Las mutaciones del FOXP2 en humanos obstaculizan el desarrollo embrionario de los circuitos cerebrales que los niños necesitan más adelante para el aprendizaje lingüístico? ¿O la actividad del FOXP2 tiene un papel durante el propio proceso de aprendizaje lingüístico? La última pregunta no se puede contestar con ratones, porque sus vocalizaciones no son como el lenguaje humano, no se aprenden imitando los sonidos de adultos de su misma especie. Los niños que nacen sordos no aprenden a hablar tan bien como los que oyen, porque el aprendizaje del habla depende de la retroalimentación auditiva. Por el contrario, los ratones sordos vocalizan exactamente igual que los ratones con audición, lo que demuestra que las vocalizaciones de los ratones no se aprenden por imitación.
A diferencia de los ratones, algunas especies de ballenas y de murciélagos sí que modifican los sonidos que utilizan para comunicarse a partir de la experiencia (Janik y Slater, 1997; Knörnschild, 2014). Estos aprendices vocales son difíciles de mantener en el laboratorio, por lo que todavía no se han realizado estudios de la función genética en murciélagos y ballenas. Muchas especies de aves canoras también aprenden a producir su canto imitando a adultos de su especie y este proceso presenta muchas similitudes conductuales y neurales con el aprendizaje del habla (Bolhuis, Okanoya y Scharff, 2010) (figura 3). Además, ya se conocen las estructuras neurales subyacentes a la producción y al aprendizaje del canto, y los genomas de aproximadamente cincuenta aves canoras se han secuenciado recientemente (Zhang et al., 2014), lo cual incrementa el interés de los estudios neurogenéticos comparativos. En este sentido, los investigadores de nuestro grupo en Berlín comprobaron que la expresión de FoxP2 se modula durante el periodo de aprendizaje del canto en una región del cerebro esencial para dicho aprendizaje (Haesler et al., 2004). Además, la reducción experimental de los niveles de FoxP2 en está región del cerebro provoca una imitación del canto incompleta e inexacta en pinzones cebra (Haesler et al., 2007). Otros experimentos nuestros y de otros investigadores han identificado factores que regulan la expresión de FoxP2 y las consecuencias celulares y conductuales de su acción (Condro y White, 2014; Wohlgemuth, Adam y Scharff, 2014). Estos y otros estudios han establecido con firmeza que FoxP2 tiene dos funciones, una en el desarrollo neural y otra «en directo» en circuitos neurales ya desarrollados (Murugan, Harward, Scharff y Mooney, 2013).
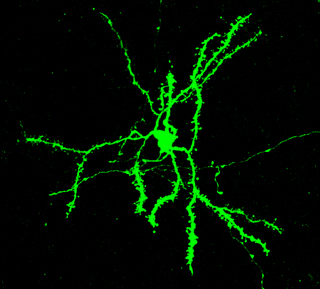
Figura 4. En aves canoras y en mamíferos, la proteína FoxP2 se expresa en lo que se conoce como neuronas espinosas medianas del cuerpo estriado, una región importante para convertir información sensorial en conductas motoras. Se conoce a estas neuronas como espinosas porque tienen «espinas», puntos en los que se reciben señales de otras neuronas. / Jennifer Kosubek
El investigador extraterrestre recapitula: «Las aves canoras aprenden a cantar de forma parecida a como los humanos aprenden a hablar, y los dos necesitan FoxP2 para hacerlo bien. ¿Cómo puede ser?»
Temas comunes
El hecho de que FoxP2 sea importante tanto para el habla humana como para el canto de las aves, dos comportamientos muy similares, y también para el aprendizaje motor en los ratones, es muy interesante desde una perspectiva evolutiva. Lo que tienen en común es que este factor de transcripción actúa en circuitos neurales que son relevantes para la conversión de estímulos sensoriales (auditivos para humanos y aves, visuales y táctiles para los ratones) en acciones motoras (el habla en humanos, el canto en las aves y el movimiento en ratones). Los circuitos neurales centrales para todos estos comportamientos son los que se conocen como ganglios basales, que son homólogos en aves, ratones y humanos. «Homólogo» en este contexto significa que estas estructuras parecen derivar de estructuras que ya existían en el ancestro común de aves y mamíferos hace 300 millones de años. La forma y la función de los ganglios basales son sorprendentemente similares en aves y mamíferos. Una teoría popular, respaldada por muchos resultados empíricos, defiende que el aprendizaje sensomotor en este circuito depende de un sistema neuroquímico de recompensa (por ejemplo, la dopamina) (figura 4). Las pruebas experimentales en ratones y aves sugieren que FoxP2 y su red molecular asociada, incluyendo las otras dos proteínas expresadas neuronalmente, FoxP1 y FoxP4, interactúan con la señal de la dopamina y regulan la potencia de las conexiones concretas entre conjuntos determinados de neuronas, afinando la integración sensomotora (Wohlgemuth et al., 2014).
«El hecho de que FoxP2 sea importante tanto para el habla humana como para el canto de las aves, es muy interesante desde una perspectiva evolutiva»
«Ah, empiezo a ver el hilo común que une toda esta historia», dirá esperanzado el extraterrestre. FOXP2, junto con otras moléculas, parece estar activa en partes del cerebro que convierten la experiencia sensorial en acción motora. Podría ayudar a un bebé a modificar sus balbuceos para crear palabras, a las aves jóvenes a ajustar sus sonidos para sonar parecido a la canción de su padre y a un ratón a aprender a usar su cuerpo con eficacia para conseguir comida y evitar ser comido.
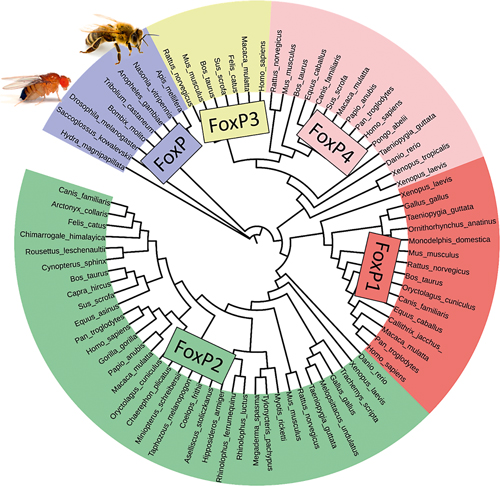
Figura 5. El gen FoxP de los invertebrados dio lugar a través de la duplicación genética a cuatro genes FoxP diferentes. En los vertebrados, FoxP1, 2 y 4 son importantes para el desarrollo del cerebro y la conducta y también cumplen una función clave para otros órganos. FoxP3 actúa en el sistema inmune. / Ezequiel Mendoza
Retroceder en el tiempo
Convertir la experiencia sensorial en acciones motoras es un requisito para la supervivencia que no es exclusivo de los vertebrados. Si la proteína FoxP2 es importante para esta función, ¿existía ya antes de que el linaje de los vertebrados apareciera? En efecto, el locus del gen FoxP2 que dio lugar a los cuatro genes FoxP diferentes en los vertebrados es muy antiguo. Parece que esos genes aparecieron al mismo tiempo que la pluricelularidad. Los coanoflagelados unicelulares no tienen el gen pero las esponjas y otros animales sin simetría bilateral sí lo tienen (Shimeld, Degnan y Luke, 2010) (figura 5). En las esponjas, FoxP realiza funciones de adherencia celular (sobre un plato de plástico) y en la formación de agregados en capas similares al epitelio. En el pulmón del ratón, FoxP1 y FoxP4 participan en el desarrollo del epitelio pulmonar (Li et al., 2012). Serán necesarios estudios más profundos para comprobar si se trata de una «coincidencia epitelial» o una homología más profunda. En el linaje Bilateria, animales con simetría bilateral, también existe un solo gen FoxP, con dos versiones distintas llamadas isoformas. FoxP se expresa en el sistema nervioso embrionario y adulto de la mosca de la fruta, lo que sugiere que podría tener una función similar a la que tiene en vertebrados (Santos, Athanasiadis, Leitão, DuPasquier y Sucena, 2011).
Para saber si FoxP podría tener funciones similares en invertebrados y en vertebrados, nuestro grupo y otros hemos empezado a estudiar su patrón de expresión y su función en moscas de la fruta (Drosophila melanogaster) y abejas (Apis mellifera) (Kiya, Itoh y Kubo, 2008; DasGupta, Ferreira y Miesenböck, 2014; Lawton, Wassmer y Deitcher, 2014; Mendoza et al., 2014) (figura 6). Como suele ocurrir en las etapas iniciales de la investigación científica de una cuestión novedosa, algunos resultados coinciden mientras que otros discrepan. En cuanto a los resultados coincidentes, todas las moscas mutantes FoxP muestran déficits conductuales interesantes que a primera vista no son incompatibles entre ellos y también podrían estar relacionados conceptualmente con los déficits conductuales observados en los vertebrados con dosis reducidas de FoxP2. Los autores de un estudio observaron una reducción en las conductas de cortejo (Lawton et al., 2014), en otro estudio las moscas aprendieron a utilizar señales visuales para evitar un castigo pero no pudieron utilizar información somatosensorial para la misma tarea (Mendoza et al., 2014), y, en un tercer estudio, las moscas mutantes tuvieron problemas para tomar decisiones utilizando señales olfativas en diferentes concentraciones y el castigo como incentivo de aprendizaje (DasGupta et al., 2014). En este último experimento, el fenotipo se pudo atribuir a un pequeño grupo determinado de neuronas que anteriormente se habían descrito como importantes para la toma de decisiones y que ahora se demostraba que también expresaban FoxP.
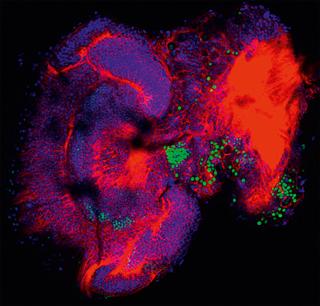
Figura 6. En el cerebro de una larva de abeja, FoxP se expresa claramente en diferentes conjuntos de neuronas (verde), indicando la importancia del gen para el desarrollo.
Existen discrepancias con respecto al patrón de expresión neural de FoxP en Drosophila, incluso cuando se utilizaron enfoques prácticamente idénticos para visualizarla. Utilizando una proteína fluorescente verde para detectar la actividad promotora de FoxP, Lawton et al. (2014) observaron expresión en lo que se conoce como complejo central, el cual podría ser funcionalmente homólogo a los ganglios basales de vertebrados según algunas hipótesis (Strausfeld y Hirth, 2013). Por el contrario, utilizando una secuencia promotora ligeramente distinta, DasGupta et al. (2014) no encontraron expresión de FoxP en el complejo central, sino en la región nuclear de los cuerpos pedunculados (mushroom bodies), un lugar de integración multimodal en el cerebro de la mosca que es importante para el aprendizaje y la memoria. Estas diferencias también podrían explicar el hecho de que un estudio indicó que las conductas motoras (caminar) eran normales (DasGupta et al., 2014), mientras que en otros estudios (Lawton et al., 2014) las conductas motoras se deterioraron. No hace falta decir que, en las condiciones experimentales, el diablo está en los detalles; por lo que, para refinar los resultados aún confusos del enfoque comparado, serán necesarios más estudios con nuevas aproximaciones que determinen los lugares de expresión del ARNm y la proteína FoxP en el sistema nervioso adulto y en desarrollo de moscas y de abejas.

Figura 7. Nuestro científico extraterrestre ha aprendido mucho sobre un gen y su viaje a través del tiempo. / Peter Schatton
Tal vez nuestro observador extraterrestre decida quedarse un poco más en este planeta, arremangarse y unirse a los científicos terrestres para tratar de descubrir si FoxP es o no un candidato a «homología profunda» que realiza funciones similares en neuronas de especies que van desde las moscas a Homo sapiens. O puede que nuestro visitante espacial esté cansado de tanta cháchara por todo el planeta y desee volverse al espacio para pensar en silencio (figura 7).
¿Es el lenguaje más que la suma de sus partes?
Acompañar a FoxP en su viaje a través de la evolución es interesante porque apunta hacia uno de los elementos esenciales del aprendizaje lingüístico: la conversión de información sensorial en acciones motoras. Pero el lenguaje es, por supuesto, más que eso. El lenguaje permite a la gente decir la verdad o contar mentiras, hablar sobre los eventos de ayer y los planes de mañana, de conceptos abstractos como la lógica y la moral, de sentimientos como la alegría o la tristeza. No se ha relacionado ningún gen directamente con el proceso por el cual los sentimientos y pensamientos se externalizan mediante el habla. Tal vez un equipo de genetistas y lingüistas extraterrestres que aterricen en la Tierra escribirá el próximo capítulo en nuestro camino hacia la comprensión de la evolución del lenguaje.
- Por convención, el gen humano se escribe en mayúsculas, FOXP2; Foxp2 se refiere a la versión del gen en ratones, y FoxP2 se utiliza para todas las demás especies. Los genes se escriben en cursiva, las proteínas, no. (Volver al texto)
REFERENCIAS:
Bolhuis, J. J., Okanoya, K., & Scharff, C. (2010). Twitter evolution: Converging mechanisms in birdsong and human speech. Nature Reviews Neuroscience, 11, 747–759. doi: 10.1038/nrn2931
Condro, M. C., & White, S. A. (2014). Recent advances in the genetics of vocal learning. Comparative Cognition & Behavior Reviews, 9, 75–98. doi: 10.3819/CCB.2014.90003
DasGupta, S., Ferreira, C. H., & Miesenböck, G. (2014). FoxP influences the speed and accuracy of a perceptual decision in Drosophila. Science, 344, 901–904. doi: 10.1126/science.1252114
Dennis, M. Y., Nuttle, X., Sudmant, P. H., Antonacci, F., Graves, T. A., Nefedov, M., … Eichler, E. E. (2012). Human-specific evolution of novel SRGAP2 genes by incomplete segmental duplication. Cell, 149, 912–922. doi: 10.1016/j.cell.2012.03.033
Enard, W., Gehre, S., Hammerschmidt, K., Hölter, S. M., Blass, T., Somel, M., … Pääbo, S. (2009). A humanized version of Foxp2 affects cortico-basal ganglia circuits in mice. Cell, 137, 961–971. doi: 10.1016/j.cell.2009.03.041
Friederici, A. D. (2006). The neural basis of language development and its impairment. Neuron, 52, 941–952. doi: 10.1016/j.neuron.2006.12.002
Graham, S. A., & Fisher, S. E. (2015). Understanding language from a genomic perspective. Annual Review of Genetics, 49, 131–160. doi: 10.1146/annurev-genet-120213-092236
Haesler, S., Rochefort, C., Georgi, B., Licznerski, P., Osten, P., & Scharff, C. (2007). Incomplete and inaccurate vocal imitation after knockdown of FoxP2 in songbird basal ganglia nucleus area X. PLoS Biology, 5, e321. doi: 10.1371/journal.pbio.0050321
Haesler, S., Wada, K., Nshdejan, A., Morrisey, E. E., Lints, T., Jarvis, E. D., & Scharff, C. (2004). FoxP2 expression in avian vocal learners and non-learners. The Journal of Neuroscience, 24, 3164–3175. doi: 10.1523/JNEUROSCI.4369-03-2004
Janik, V. M., & Slater, P. J. B. (1997). Vocal learning in mammals. En P. Slater, J. Rosenblatt, Ch. Snowdon, & M. Milinski (Eds.), Advances in the study of behavior. Vol. 24 (pp. 59–99). San Diego, CA: Academic Press.
Kiya, T., Itoh, Y., & Kubo, T. (2008). Expression analysis of the FoxP homologue in the brain of the honeybee, Apis mellifera. Insect Molecular Biology, 17, 53–60. doi: 10.1111/j.1365-2583.2008.00775.x
Knörnschild, M. (2014). Vocal production learning in bats. Current Opinion in Neurobiology, 28, 80–85. doi: 10.1016/j.conb.2014.06.014
Kuhl, P., & Meltzoff, A. (1982). The bimodal perception of speech in infancy. Science, 218, 1138–1141. doi: 10.1126/science.7146899
Lai, C. S. L., Fisher, S. E., Hurst, J. A., Vargha-Khadem, F., & Monaco, A. P. (2001). A forkhead-domain gene is mutated in a severe speech and language disorder. Nature, 413, 519–523. doi: 10.1038/35097076
Lawton, K. J., Wassmer, T. L., & Deitcher, D. L. (2014). Conserved role of Drosophila melanogaster FoxP in motor coordination and courtship song. Behavioural Brain Research, 268, 213–221. doi: 10.1016/j.bbr.2014/04.009
Li, S., Wang, Y., Zhang, Y., Lu, M. M., DeMayo, F. J., Dekker, J. D., Tucker, P. W., & Morrisey, E. E. (2012). Foxp1/4 control epithelial cell fate during lung development and regeneration through regulation of anterior gradient 2. Development, 139, 2500–2509. doi: 10.1242/dev.079699
Mendoza, E., Colomb, J., Rybak, J., Pflüger, H.-J., Zars, T., & Scharff, C. (2014). Drosophila FoxP mutants are deficient in operant self-learning. Plos One, 9(6), e100648. doi: 10.1371/journal.pone.0100648
Murugan, M., Harward, S., Scharff, C., & Mooney, R. (2013). Diminished FoxP2 levels affect dopaminergic modulation of corticostriatal signaling important to song variability. Neuron, 80(6), 1464–1476. doi: 10.1016/j.neuron.2013.1009.1021
Santos, M. E., Athanasiadis, A., Leitão, A. B., DuPasquier, L., & Sucena, É. (2011). Alternative splicing and gene duplication in the evolution of the FoxP gene subfamily. Molecular Biology and Evolution, 28, 237–247. doi: 10.1093/molbev/msq182
Shimeld, S. M., Degnan, B., & Luke, G. N. (2010). Evolutionary genomics of the Fox genes: Origin of gene families and the ancestry of gene clusters. Genomics, 95, 256–260. doi: 10.1016/j.ygeno.2009.08.002
Strausfeld, N. J., & Hirth, F. (2013). Deep homology of arthropod central complex and vertebrate basal ganglia. Science, 340, 157–161. doi: 10.1126/science.1231828
Vargha-Khadem, F., Gadian, D. G., Copp, A., & Mishkin, M. (2005). FOXP2 and the neuroanatomy of speech and language. Nature Reviews Neuroscience, 6, 131–138. doi: 10.1038/nrn1605
Watkins, K. E., Dronkers, N. F., & Vargha-Khadem, F. (2002). Behavioural analysis of an inherited speech and language disorder: Comparison with acquired aphasia. Brain, 125, 452–464. doi: 10.1093/brain/awf058
Wohlgemuth, S., Adam, I., & Scharff, C. (2014). FoxP2 in songbirds. Current Opinion in Neurobiology, 28, 86–93. doi: 10.1016/j.conb.2014.06.009
Zhang, G., Li, B., Li, C., Gilbert, M., Jarvis, E., Wang, J. & Consortium, T. A. G. (2014). Comparative genomic data of the Avian Phylogenomics Project. GigaScience, 3, 26. doi: 10.1186/2047-217X-3-26
AGRADECIMIENTOS:
Agradecemos a Arturo y Anna Zychlinsky por sus útiles comentarios editoriales, a Kate Watkins por suministrar las palabras sin sentido para evaluar la ejecución del habla y a Peter Schatton por prestar su talento artístico para crear las figuras 1 y 7, y a Ezequiel Mendoza por modificar la figura 5. Pedimos disculpas a los autores cuyos descubrimientos no aparecen en las referencias debido a constricciones de espacio. La investigación realizada en el laboratorio de las autoras ha recibido financiación del Excellence Cluster Neurocure y el SFB 665 «Developmental Disturbances of the Nervous System».