Más allá del recuento de especies
Una nueva manera de enfocar la biodiversidad

Los índices tradicionales de diversidad (principalmente riqueza, abundancia y equitatividad de especies) han sido altamente reveladores para el seguimiento de procesos en comunidades y ecosistemas en ecología moderna. Sin embargo, hace aproximadamente dos décadas, un grupo de investigadores, pioneros en su campo, apreciaron que estos índices no resolvían por completo las cuestiones que se proponían. Por ello plantearon cambiar el modo de cuantificar la biodiversidad. Fundamentalmente, esta nueva metodología considera la distancia entre las especies (en términos filogenéticos o funcionales) de forma previa a aplicar los índices de biodiversidad oportunos. La incorporación de elementos filogenéticos y funcionales en la evaluación de la diversidad permite acercarnos al concepto de biodiversidad de manera más completa.
Palabras clave: índices clásicos de diversidad, diversidad funcional, diversidad filogenética, rasgos funcionales, distancias genéticas.
La biodiversidad o diversidad biológica es un concepto que hace referencia a la variedad de la vida sobre la Tierra como resultado de miles de millones de años de evolución. Probablemente lo primero que venga a nuestra mente al oír esta palabra sean escenarios idealizados: selvas tropicales de árboles verdes, leñosos y frondosos, pobladas por mamíferos y aves exóticas, y quizás incluyamos en nuestra foto mental algún insecto vistoso, como una mariposa de colores llamativos. O, tal vez, evoquemos un arrecife de coral en el que naden peces combinados en colores imposibles. Sin embargo, la dimensión «evolutiva» del término biodiversidad nos hace sospechar que debe haber algo más en este escenario.
«Para gestionar la biodiversidad es fundamental realizar una cuantificación fiable que tenga en cuenta los diferentes niveles de organización»
La vida sobre la Tierra abarca un gran número de grupos vegetales y animales, pero también muchos otros eucariotas (organismos con células nucleadas) y aún más grupos de procariotas (organismos con células sin núcleo). Todas estas formas de vida son protagonistas de los procesos que se dan en los ecosistemas. Es por estos procesos por los que conocer la biodiversidad del medio natural ha sido una inquietud constante para el ser humano. Primero, para ponerla a su servicio o extraer sus recursos; después, para conservarla por razones que pueden ir más allá del mero utilitarismo, incorporando una dimensión eudemónica a la conservación, y, durante las últimas décadas, para evaluar y mitigar el impacto de las perturbaciones ligadas al cambio climático sobre la vida en el planeta. La biodiversidad engloba variabilidad a tres niveles: «entre ecosistemas»; entre las unidades taxonómicas (por simplificar, en adelante especies)1 que habitan en los ecosistemas («interespecífica»), y dentro de cada una de las especies («intraespecífica») (Glowka, Burhenne-Guilmin, Synge, McNeely y Gündling, 1994). Por ello, uno de los pilares fundamentales para gestionarla es realizar una cuantificación fiable que tenga en cuenta estos niveles de organización.
Descomposición espaciotemporal de la biodiversidad
Históricamente, los ecólogos pronto fueron conscientes de que la variabilidad biológica puede presentar patrones diferentes dependiendo de la escala considerada. Whittaker (1960) fue el primero en describir los diferentes componentes espaciales en los que se puede medir la biodiversidad. Este autor propuso abordar el estudio de la biodiversidad a lo largo de una serie de escalas espaciales jerárquicas (Figura 1). Así definió la diversidad gamma (γ) como la diversidad de especies en una región o ecosistema. Por su parte, la escala jerárquica más baja, correspondiente al punto de muestreo, recibió el nombre de la diversidad alfa (α). Por último, definió la diversidad beta (β), que establece la desemejanza entre dos módulos comparables, normalmente correspondiendo a un mismo nivel jerárquico, como por ejemplo la desemejanza de biodiversidad entre varios puntos de muestreo.
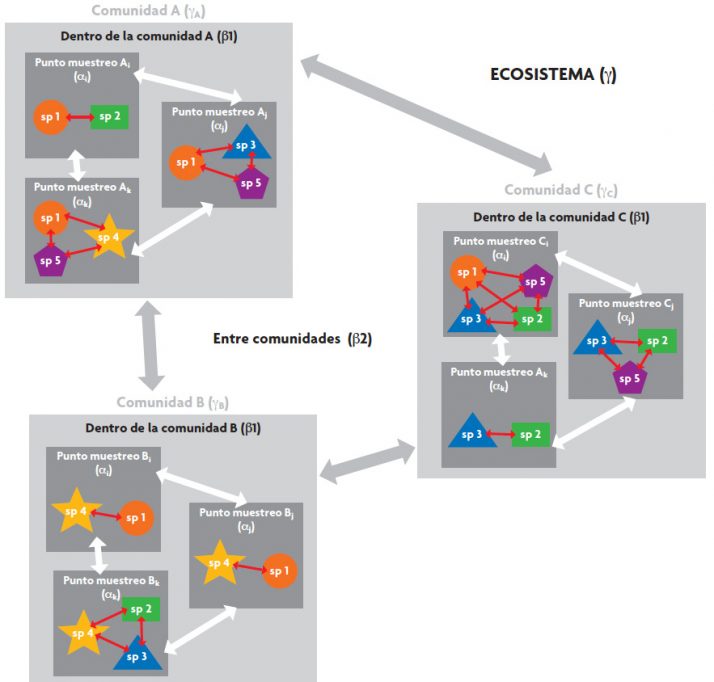
Figura 1. La biodiversidad puede medirse teniendo en cuenta diferentes escalas, entre ellas la espacial. En el esquema observamos un ejemplo de los diferentes componentes espaciales en los que se puede medir la biodiversidad teniendo en cuenta un ecosistema compuesto por tres comunidades (A, B, C). En cada comunidad se han registrado las especies (sp) presentes en tres puntos de muestreo (i, j, k). La diversidad gamma es la diversidad de especies que hay en el ecosistema (γ) o comunidad (γA, γB, γC). La diversidad en el punto de muestreo es la diversidad alfa (α). La diversidad beta 1 (β1) es la desemejanza entre los puntos de muestreo dentro de una misma comunidad y la diversidad beta 2 (β2) es la desemejanza entre las comunidades de un ecosistema. Las flechas blancas y grises hacen referencia a las diferencias que miden los índices de biodiversidad entre los puntos de muestreo o comunidades para calcular los componentes beta 1 y 2, respectivamente. Las flechas rojas indican la posibilidad de calibrar la distancia entre especies (en términos de distancias genéticas o funcionales) previamente a medir la biodiversidad.
Debido a su gran utilidad y extendido uso, posteriormente surgió la necesidad de redefinir el componente beta. Así pues, se hizo la distinción entre diversidad beta 1 (β1), como la desemejanza entre los puntos de muestreo dentro de una misma comunidad; y diversidad beta 2 (β2), como la desemejanza entre las comunidades de una región (Excoffier, Smouse y Quattro, 1992) (véase Figura 1). Actualmente, los últimos estudios en este campo proponen una descomposición temporal de la biodiversidad, análoga a la espacial. De este modo, la escala jerárquica se podría extender a módulos temporales anidados, como por ejemplo años, décadas y siglos. Una consecuencia lógica de este diseño es la posibilidad de combinar los aspectos espaciotemporales de la biodiversidad, pero este enfoque está todavía poco desarrollado (Pavoine y Bonsall, 2011).
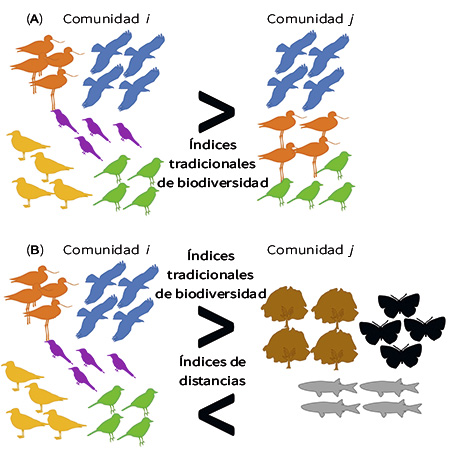
Figura 2. Las figuras A y B muestran dos comunidades con una misma abundancia en todas las especies presentes, aunque con una mayor riqueza de especies en la comunidad i que en la comunidad j en ambos casos. No obstante, en la comunidad j de la figura B se han reemplazado las especies por otras filogenética o funcionalmente distantes. De acuerdo con los índices tradicionales de biodiversidad, tanto en (A) como en (B) la comunidad i es más diversa que la comunidad j. Mientras que, de acuerdo con los índices de distancias (diversidad filogenética y diversidad funcional), en (B) la comunidad j es más diversa que la comunidad i.
¿Cómo medimos la biodiversidad?
Independientemente de la escala espacio-temporal (α, β, γ), los índices que se han venido utilizando para cuantificar y caracterizar la diversidad se han basado primordialmente en evaluar la variabilidad a nivel «interespecífico», por ser este mucho más fácil de apreciar y cuantificar. En cambio, las diversidades «intraespecífica» y de «ecosistemas» han recibido mucha menor atención. Los índices tradicionales de biodiversidad cuantifican principalmente la riqueza, la abundancia y la equitatividad de las especies de interés presentes en una muestra. Así, dada una muestra definida a escala espacial o temporal, la riqueza de especies indica el número de especies presentes, la abundancia cuantifica el número de individuos de cada especie y, por último, la equitatividad relaciona la riqueza y la abundancia, de forma que establece el grado en el que los individuos se reparten entre las especies contadas en la muestra. Gracias a estos índices tradicionales se ha podido caracterizar la biodiversidad de forma fácil e intuitiva a cualquier escala espacial (α, γ) e incluso realizar comparaciones entre módulos del mismo nivel jerárquico (β).
No obstante, estos índices no ofrecen todos los matices necesarios para obtener una idea completa de la biodiversidad, porque desatienden dos de sus dimensiones: la filogenética y la funcional. Por ejemplo, si aplicamos los índices tradicionales a dos comunidades (comunidad i y comunidad j, tal y como observamos en la Figura 2a), en las que encontramos la misma abundancia en todas las especies presentes y con una riqueza de especies Si = 5 y Sj = 3, la equitatividad será Ei = 100 % y Ej = 100 %.
Sin embargo, cuando reemplazamos las especies de la comunidad j por otras filogenética (genéticamente) o funcionalmente (que aportan y ocupan servicios muy diferentes en el ecosistema) distantes (Figura 2b), los índices tradicionales de biodiversidad seguirán proporcionándonos los mismos resultados relativos. Es decir, la comunidad i será más diversa que la j, sin considerar lo diferentes que son las especies de las comunidades. Este ejemplo claramente muestra una limitación fundamental de los índices de biodiversidad tradicionales. Por esta razón, durante las últimas décadas, un buen número de ecólogos se han esforzado por definir un nuevo marco matemático que describa las diferencias filogenéticas y funcionales de las especies de una comunidad.
Entre las primeras aproximaciones, Faith (1992) intentó evaluar y considerar las distancias filogenéticas entre especies. Este autor expuso que, antes de medir la biodiversidad de una muestra dada, se deberían calibrar las distancias filogenéticas de las especies que componen dicha muestra. De este modo, se podría conocer la singularidad evolutiva de cada linaje (separación más o menos próxima en el tiempo). Así, propuso medir el parentesco filogenético entre las especies de una muestra como una matriz entre pares de especies. Esta matriz se extrae de la distancia en un árbol filogenético entre cada par de especies. De este modo, decimos que cualquier estudio que base sus medidas de biodiversidad en las distancias filogenéticas entre especies será un estudio de diversidad filogenética.
«Los ecólogos pronto fueron conscientes de que la variabilidad biológica puede presentar patrones diferentes dependiendo de la escala considerada»
Posteriormente Petchey y Gaston (2002) plantearon un protocolo análogo al de Faith (1992), pero en este caso las relaciones entre especies no se construyen a partir de secuencias filogenéticas, sino a partir de rasgos funcionales.2 Los rasgos funcionales son las unidades utilizadas para medir la diversidad funcional de un conjunto de especies y permiten evaluar las consecuencias de una gran variedad de cuestiones ecológicas, por ejemplo: el impacto del cambio climático en la diversidad o la sucesión ecológica tras la restauración de un hábitat. En este caso, se mediría la complementariedad funcional entre las especies de nuestra muestra, para así construir una matriz de distancias entre cada par de especies, a partir de datos de rasgos funcionales. Al cruzar esta matriz con el índice adecuado de biodiversidad, sabremos lo diversa que es nuestra muestra en términos de diversidad funcional.
Si finalmente volvemos a examinar la Figura 2b y, previamente a medir la biodiversidad de cada muestra, calibramos la distancia entre las especies de nuestras comunidades en términos de distancias filogenéticas (diversidad filogenética) o funcionales (diversidad funcional), veremos que nuestra conclusión acerca de cuál es la comunidad más diversa se ve alterada por completo.
¿Qué han aportado estos estudios?
De los estudios de las últimas décadas, podemos extraer afirmaciones tan llamativas como que un aparatoso arrecife de coral es menos biodiverso que un austero ecosistema de montaña (Figura 3). Si bien en el primero se ha visto favorecida la radiación o aparición de nuevas especies, estas son filogenéticamente muy próximas y prácticamente iguales a nivel funcional. Por ello, si añadimos o extraemos una especie del ecosistema, los valores de diversidad filogenética o funcional permanecerán prácticamente inmutables. Por contra, el ecosistema de montaña tiene un menor número de especies, pero estas son filogenética y funcionalmente muy distantes, por lo que perder una de las especies conllevaría una caída drástica de los valores de diversidad filogenética o funcional.

Figura 3. De acuerdo con los índices tradicionales de diversidad, la comunidad de peces de un arrecife de coral (a la derecha) sería más biodiversa que todo un ecosistema de montaña (a la izquierda), por tener el primero un mayor número de especies. Sin embargo, estas especies son filogenética (evolutiva) y funcionalmente (ecológicamente) similares, por lo que resultan redundantes en términos de diversidad filogenética y funcional. Mientras que, en el ecosistema de montaña, aun con un menor número de especies, cada una de ellas es filogenética y funcionalmente diferente al resto. / Adi Ulici, NOAA
No pretendemos indicar con esto que un ecosistema coralino no sea igual de merecedor de ser conservado que uno de alta montaña. Lo que queremos transmitir, sin embargo, es que la debida consideración de los aspectos funcionales y filogenéticos de las comunidades biológicas nos ayudan a entender mejor la organización de la biodiversidad en el planeta y deben ser tenidos en cuenta a la hora de establecer medidas concretas de conservación.
¿Próxima parada?
La realización de estos estudios es más compleja que en el caso de las aproximaciones tradicionales, ya que requieren afrontar dos retos en primera instancia. El primero es la identificación de rasgos funcionales significativos y no redundantes para cuantificar la diversidad funcional. El segundo es la disponibilidad de información sobre las relaciones de parentesco entre las especies para poder cuantificar la diversidad filogenética. Sin embargo, es interesante señalar que, a diferencia de los índices de biodiversidad tradicionales, los conceptos de diversidad filogenética y funcional son directamente aplicables a nivel de individuo. A pesar de haber sido poco explorada, esa aproximación posibilita la extensión a estudios de diversidad intraespecífica, lo que permite la integración de este aspecto en estudios de biodiversidad. Por ejemplo, medir la diversidad filogenética intraespecífica podría ser crucial a la hora de entender los patrones filogeográficos y reconocimiento de subespecies, para así implantar planes de conservación biológica (Excoffier, 2008).
«De los estudios de las últimas décadas, podemos extraer afirmaciones tan llamativas como que un aparatoso arrecife de coral es menos biodiverso que un austero ecosistema de montaña»
Además, los índices de diversidad filogenética y funcional han servido para caracterizar un gran número de ecosistemas terrestres y acuáticos, tomando como modelo desde vegetales herbáceos o leñosos a insectos y vertebrados. No obstante, consideramos que todavía quedan muchos campos de aplicación. Por ejemplo, los parásitos, por su modo de vida dependiente de otro organismo, tienen características que los hacen idóneos para revelar procesos ocultos en los ecosistemas. Asimismo, los parásitos son ubicuos en todos los ecosistemas; algunos tienen ciclos de vida complejos, por lo que son útiles para trazar rutas en las redes tróficas y dilucidar patrones espaciotemporales de los ecosistemas (Poulin y Morand, 2000). A pesar de ello, pocos autores han abordado el estudio de la biodiversidad de las comunidades de parásitos desde el punto de vista filogenético o funcional. Los estudios más recientes indican que los organismos parásitos realizan funciones reguladoras, protectoras y estabilizadoras en los ecosistemas. Además, el estudio de los sistemas parásito-hospedador aporta un potente instrumento comparativo, debido a la organización anidada3 de las comunidades parásitas, que puede arrojar conclusiones generalizables a otras comunidades biológicas.
Conclusión
Actualmente, es difícil concebir un estudio que explique o prediga los procesos que tienen lugar en los ecosistemas sin incluir datos filogenéticos o funcionales de las unidades taxonómicas consideradas en la muestra. Sin embargo, nos gustaría destacar que los estudios basados en la comparación de los resultados obtenidos mediante diferentes índices de biodiversidad, así como a diferentes escalas jerárquicas de organización, pueden revelar procesos evolutivos, biogeográficos o de radiación que de otra forma pasarían inadvertidos. Por ello, invitamos a los investigadores interesados a utilizar este nuevo marco conceptual en sus estudios.
1. En el texto simplificamos la descripción de unidad taxonómica equiparándola a la descripción de especie biológica. No obstante, cabe destacar que los índices de biodiversidad, tanto los tradicionales como los basados en distancias filogenéticas o funcionales, pueden aplicarse a cualquier nivel de la clasificación taxonómica de los organismos e incluso a virus (Shi et al., 2016), que en ciertos ámbitos se escapan de la definición de organismo biológico. (Volver)
2. De acuerdo con Carmona, De Bello, Mason & Lepš (2016), un rasgo funcional es cualquier característica morfológica, fisiológica, fenológica o comportamental, que se puede medir a nivel de individuo y tiene un efecto sobre su supervivencia o reproducción. (Volver)
3. Los análisis de conjuntos anidados (por ejemplo, asociaciones parásito-hospedador) pueden revelar patrones ecológicos no aleatorios y son herramientas exploratorias útiles para sugerir mecanismos que pueden estructurar una comunidad en particular (González y Poulin, 2005). (Volver)
Referencias
Carmona, C. P., De Bello, F., Mason, N. W. H., & Lepš, J. (2016). Traits without borders: Integrating functional diversity across scales. Trends in Ecology & Evolution, 31(5), 382–394. doi: 10.1016/j.tree.2016.02.003
Excoffier, L. (2008). Analysis of population subdivision. In D. J. Balding, M. Bishop, & C. Cannings (Eds.), Handbook of statistical genetics (pp. 980–1020). Chichester: John Wiley & Sons Ltd. doi: 10.1002/9780470061619.ch29
Excoffier, L., Smouse, P. E., & Quattro, J. M. (1992). Analysis of molecular variance inferred from metric distances among DNA haplotypes: Application to human mitochondrial DNA restriction data. Genetics, 131(2), 479–491.
Faith, D. P. (1992). Conservation evaluation and phylogenetic diversity. Biological Conservation, 61(1), 1–10. doi: 10.1016/0006-3207(92)91201-3
Glowka, L., Burhenne-Guilmin, F., Synge, H., McNeely, J. A., & Gündling, L. (1994). A guide to the convention on biological diversity (N.º 333.95 G946). Gland/Cambdrige/Bonn: IUCN and Environmental Law Centre IUCN.
González, M. T., & Poulin, R. (2005). Nested patterns in parasite component communities of a marine fish along its latitudinal range on the Pacific coast of South America. Parasitology, 131(4), 569–577. doi: 10.1017/S0031182005007900
Pavoine, S., & Bonsall, M. B. (2011). Measuring biodiversity to explain community assembly: A unified approach. Biological Reviews, 86(4), 792–812. doi: 10.1111/j.1469-185X.2010.00171.x
Petchey, O. L., & Gaston, K. J. (2002). Functional diversity (FD), species richness and community composition. Ecology Letters, 5(3), 402–411. doi: 10.1046/j.1461-0248.2002.00339.x
Poulin, R., & Morand, S. (2000). The diversity of parasites. The Quarterly Review of Biology, 75(3), 277–293. doi: 10.1086/393500
Shi, M., Lin, X. D., Tian, J. H., Chen, L. J., Chen, X., Li, C. X., ... Zhang, Y.-Z. (2016). Redefining the invertebrate RNA virosphere. Nature, 540(7634), 539–543. doi: 10.1038/nature20167
Whittaker, R. H. (1960). Vegetation of the Siskiyou Mountains, Oregon and California. Ecological Monographs, 30(3), 279–338. doi: 10.2307/1943563





